摘要:本文作者用基于配体的策略,从几个已知的17β-HSD2抑制剂用Ligandscout生成基于配体的药效团模型,再用这个模型对天然产物数据库进行虚拟筛选,发现IC50在μM-nM水平的化合物。
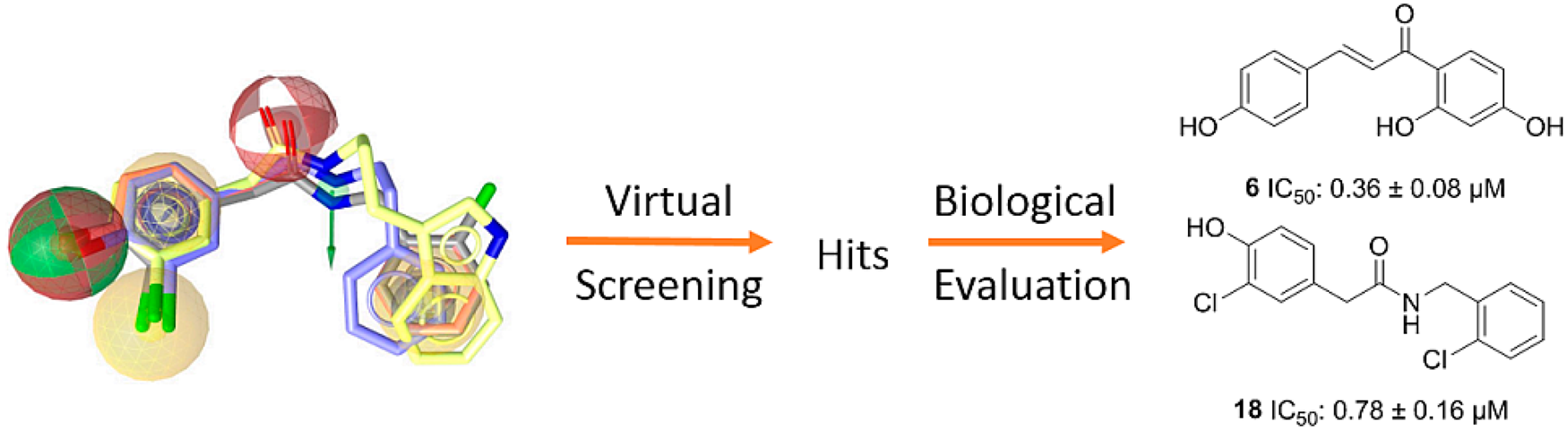
原文: Vuorinen, A.; Engeli, R. T.; Leugger, S.; Bachmann, F.; Akram, M.; Atanasov, A. G.; Waltenberger, B.; Temml, V.; Stuppner, H.; Krenn, L.; Ateba, S. B.; Njamen, D.; Davis, R. A.; Odermatt, A.; Schuster, D. Potential Antiosteoporotic Natural Product Lead Compounds That Inhibit 17β-Hydroxysteroid Dehydrogenase Type 2. J. Nat. Prod. 2017, 80 (4), 965–974. DOI:10.1021/acs.jnatprod.6b00950
一. 摘要
17β-HSD2(17β-Hydroxysteroid dehydrogenase type 2)通过将活性类固醇激素雌二醇、睾酮以及5α-二氢睾酮转化成弱活性的雌激素酮(Estrone)、Δ4-雄甾烯-3,17-二酮、5α-雄(甾)烷-3,17-二酮来调节细胞与组织中的类固醇作用。因为活性类固醇水平的降低会伴随着骨健康与骨质疏松的发生,所以17β-HSD2被认为是抗骨质疏松治疗靶标。为了从天然产物中发现新的先导化合物,本研究用基于17β-HSD2抑制剂的药效团模型来虚拟筛选天然产物数据库,并进一步对虚拟筛选命中的36个化合物进行了生物学评价,其中12个化合物对17β-HSD2表现出IC50为几个μM到nM水平的抑制活性。活性最强的几个化合物分别为去甲二氢愈创木酸(IC50 = 0.38 ± 0.04 μM)、二氢愈创木酸(IC50 = 0.94 ± 0.02 μM)、异甘草素(IC50 = 0.36 ± 0.08 μM)、香兰酸乙酯(IC50 = 1.28 ± 0.26 μM), 而且对17β-HSD1表现出8倍或更高的选择性。因为有的化合物属于同一类结构,所以从这些化合物还可获得构效关系(SAR)。总的来说,本研究描述了如何从天然产物中发现新的 17β-HSD2抑制剂并探索了17β-HSD2的结合口袋,为将来本领域的研究提供有前景的前期工作。
二. 前言
由于17β-HSD2合适的分布特点以及对骨细胞中estradiol、testosterone、5α-dihydrotestosterone灭活作用(图1),使得17β-HSD2是一个有前途的骨质疏松症指标靶标。
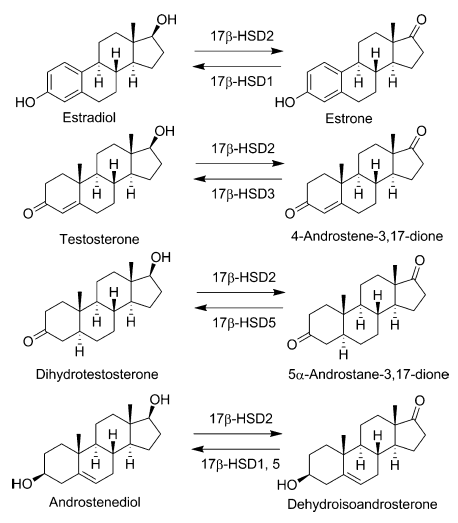
图1.17β-HSD2催化的酶学反应以及被其它HSD酶催化的逆向反应
虽然已经有文献报道过多个合成的17β-HSD2抑制剂,但是天然产物却鲜有报道。目前报道的天然产物主要是黄酮类化合物。因为黄酮与甾体具有类似的官能团,所以可以将黄酮视为甾体拟似物。虽然如此,黄酮类化合物并不具备靶标选择性,它还抑制同家族的其它酶,此外还作用于雌激素与雄激素受体。鉴于天然产物在药物发现先导化合物起的重要作用,因此还是对从天然产物中发现选择性的17β-HSD2抑制剂非常感兴趣。
三. 基于配体的药效团建模
此前,已经用几个已知17β-HSD2建立了基于配体的药效团模型并用于虚拟筛选化成化合物数据库1,其中Model 1与Model 2表现出良好的预测能力,阳性化合物命中率分别为50%,10%。这两个模型很相似,但稍有区别。主要体现在药效团元素的位置不同,这个差异导致了两个模型命中不同的化合物(见图2)。现在就用这两个模型对天然产物进行虚拟筛选。
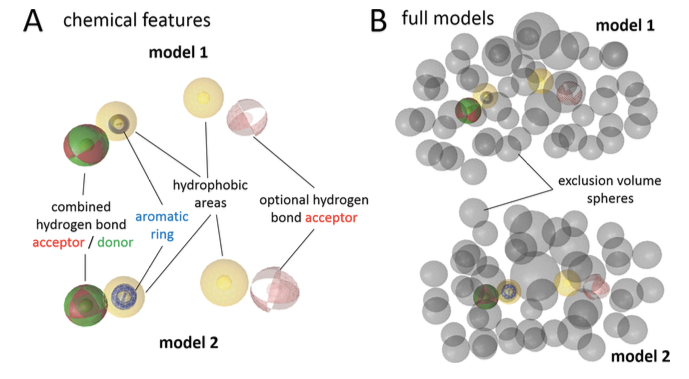
图2. 17β-HSD2抑制剂药效团模型
四. 虚拟筛选
1. 数据库的准备
天然产物的来源见表1,Ligandscout3.03B内置的OMEGA对数据库化合物进行去盐、生成多构象文件,采用BEST模式,每个分子最多保留500个构象。其中对Sigma数据库来源的天然产物采用FAST模式,每个化合物最多保留50个构象。
表1. 虚拟筛选的化合物来源
| Database | Organization | Entries | Hits Model 1 without/with one omitted feature | Hits Model 2 without/with one omitted feature | Tested compounds |
|---|---|---|---|---|---|
| Davis | Griffith University | 352 | 10/64 | 17/79 | 18 |
| Atanasov | University of Vienna | 51 | 1/13 | 0/11 | 12 |
| Krenn | University of Vienna | 13 | 0/0 | 0/3 | 2 |
| Sigma | Sigma-Aldrich | 67748 | 120/not screened | not screened | 3 |
| Waltenberger | University of Innsbruck | 23 | 0/12 | 2/9 | 1 |
2. 虚拟筛选结果
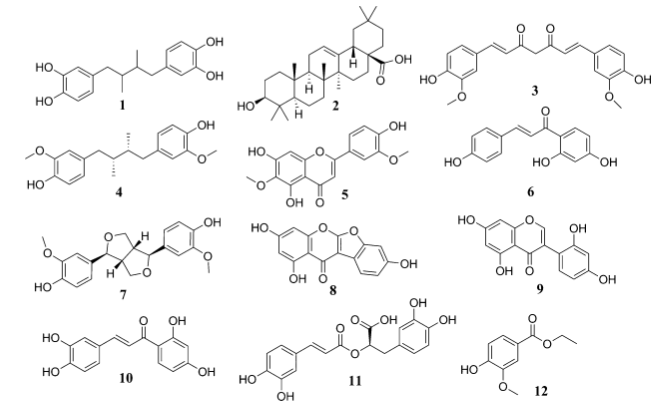
图3. 虚拟筛选后选择了36个化合物进一步做活性验证,最后发现12个17β-HSD2抑制剂
12个天然产物的17β-HSD2抑制活性见表2。
表2. 虚拟筛选命中化合物的活性验证结果
| Compound | Database | Remaining activity at 20 μM (% of control) or IC50 |
|---|---|---|
| nordihydroguaiaretic acid (1) | Atanasov | 0.38 +/- 0.04 μM |
| oleanolic acid (2) | Atanasov | 49 +/- 6% |
| curcumin (3) | Atanosov | 1.73 +/- 0.2 μM |
| (−)-dihydroguaiaretic acid (4) | Davis | 0.94 +/- 0.02 μM |
| jaceosidin (5) | Davis | 9.3 +/- 2.3 μM |
| isoliquiritigenin (6) | Davis | 0.36 +/- 0.08 μM |
| pinoresinol (7) | Waltenberger | 42 +/- 5% |
| lupinalbin A (8) | Krenn | 1.52 +/- 0.15 μM |
| 2′-hydroxygenistein (9) | Krenn | 2.03 +/- 0.37 μM |
| butein (10) | Sigma | 7.3 +/- 2.7 μM |
| rosmarinic acid (11) | Sigma | 3.72 +/- 0.17 μM |
| ethyl vanillate (12) | Sigma | 1.28 +/- 0.26 μM |
五. 相关文献
Anna Vuorinen et al. Ligand-Based Pharmacophore Modeling and Virtual Screening for the Discovery of Novel 17β -Hydroxysteroid Dehydrogenase 2 Inhibitors. J. Med. Chem. 2014, 57:5995 −6007.
案例讲解:http://blog.molcalx.com.cn/2017/09/01/ligandscout-vuorinen-2014-jmc.html
六. 本文亮点
- 基于配体的药效团建模
- 天然产物虚拟筛选发现17β-HSD2抑制剂



