摘要:本文介绍了Cresset应用软件Flare,Blaze与Spark中的场约束与药效团约束,并讨论了这两种约束方法的差异与优缺点,以及什么时候应该使用场约束,什么时候应该使用药效团约束。答案是,如果您确定必须保留药效团相互作用,那么使用药效团约束可能是合理的;如果相互作用方式并不总是以相同的形式出现,则场约束可能更合适。
作者:Mark Mackey/23 April, 2018
编译:肖高铿/2018-04-30
修订:肖高铿/2023-04-03 因为Torch、Forge等软件已经停止发布并作为Flare的一部分,所以对原文进行了修订以适应现有的软件。
Cresset的分子叠合和打分技术是基于静电匹配理念:一对构象的“最佳”叠合通常是分子间相互作用势最相似的那个。在大多数情况下这是真的。然而,我们认识到通常静电势的某些部分,例如涉及强氢键的部分,可能比其他部分更重要。这不是分子本身固有的信息,而是它们所处环境的信息。因此,我们多年来一直采用添加“场约束”来迫使叠合算法优先匹配配体周围特定位置的静电势。
值得注意的是,场约束算法的工作原理是对违反约束的叠合施以惩分,而不是强制匹配约束(图 1)。一般来说,通过惩分传递的软约束优于硬约束,在硬约束中我们只是不允许违反约束的分子叠合出现。在这背后有两个原因。首先,使用罚分可以调整约束的强度,因此它可以是从温和的提示到严格的要求。其次,在大多数情况下,我们认为获得违反约束的最大努力叠合比什么都不做要好,尤其是在先导化合物优化过程中使用算法并尝试叠合一组已知活性的化合物时。
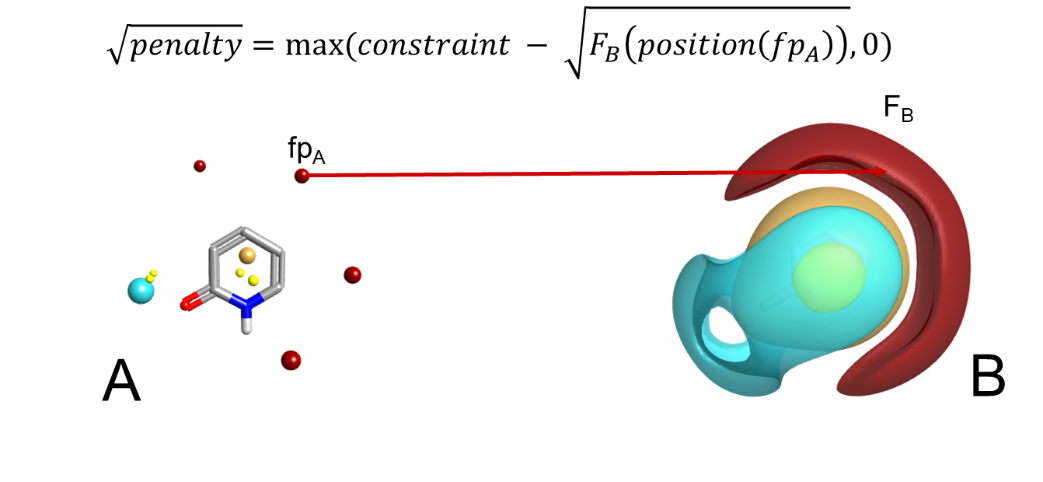
图1. 场约束要求特定场点位置的场具有某个最小值
虽然场约束在大多数情况下非常有效,但也有例外。在某些情况下,在您想要添加约束的地方可能没有场点,尽管Flare、Forge(现在已经合并到Flare里)和Spark中的场编辑器缓解了这个问题。 更常见的是,您要添加的约束比通过场点表达的约束更强或更具体:有时通用的正电势是不够的,例如您想要明确要求氢键供体,有时您想要确保一组配体中的金属螯合基团叠合对齐,并且“良好的金属螯合剂”同样难以用纯静电特征来确定。 此外,激酶铰链结合区所需的供体-受体模组很难单独通过场来描述,因为供体和受体静电在某种程度上相互抵消,使得该区域对整体叠合打分的贡献要小于它实际的贡献。
出于这些原因,我们在核心算法中引入了药效团约束选项。因为它们是约束而不是要求,因此以类似于场约束的方式运行。传统的药效团算法将药效团视为二元开关:您要么在空间区域有氢键供体,因此完全匹配;要么没有,因此没有匹配。我们的药效团约束是按光滑的比例运行的。您指定约束有多强,如果不满足约束,那么就会损失多少的叠合打分值。我们花了一段时间研究惩罚函数应该采用什么形式,总体上最好的形式是一个简单的线性惩罚,在2Å距离处有一个上限,如图2所示。
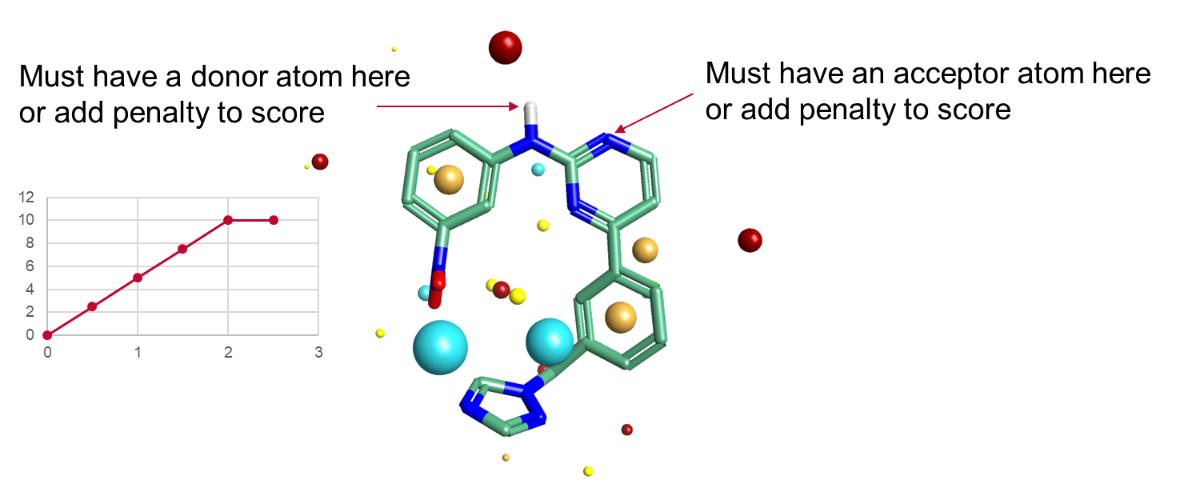
图2:药效团约束要求指定类型的原子出现在受约束原子的2Å范围内,否则将对打分值施以惩罚
我们在其他地方讨论了药效团约束对Blaze虚拟筛选性能的验证,对于某些靶标,它们可以产生显著差异。然而,新的约束不仅仅对虚拟筛选有效。添加约束对配体叠合成功的概率有什么影响?
我们使用Giangreco等人1的标准AZ/CCDC数据集对此进行了研究。该数据集包含大量靶标,并且每个靶标都有一组叠合过的共结晶配体。 通过衡量一个靶标类别中的配体被成功叠合的比例,该数据集可用于验证配体叠合算法。然而,对整个数据集进行验证具有挑战性,因为这会面临一个问题:对于每一个靶标,我应该用哪些药效团约束。做为第一个算例,我们决定仅测试其中4个激酶靶标来解决这个问题,因为激酶的供体-受体-供体模组已广为人知并且没有争议。对于这4个靶标数据集中的每个配体,我们根据该配体实际产生的氢键数量手动对铰链结合区应用1到3个药效团约束。出于本实验的目的,我们仅考虑对来自O或N上氢的“真实”氢键,而不考虑较弱的C-H氢键形式。请注意,所有的叠合仅在配体空间中进行,没有利用蛋白的信息。
结果的分布如图3所示。我们用RMS=2Å截断值来区分正确和错误的叠合。可以看出,在未使用约束条件时不正确的分子叠合算例中,大约13%通过添加约束之后得以挽救——这是显著的改进。然而,与此同时,大约3%的正确叠合因为添加约束而变得更糟,而且很明显还有许多不正确的叠合因施加约束而保持不变。总的来说,添加药效团是约束获得净赢,尤其是对于这些激酶数据集,但它不是灵丹妙药。
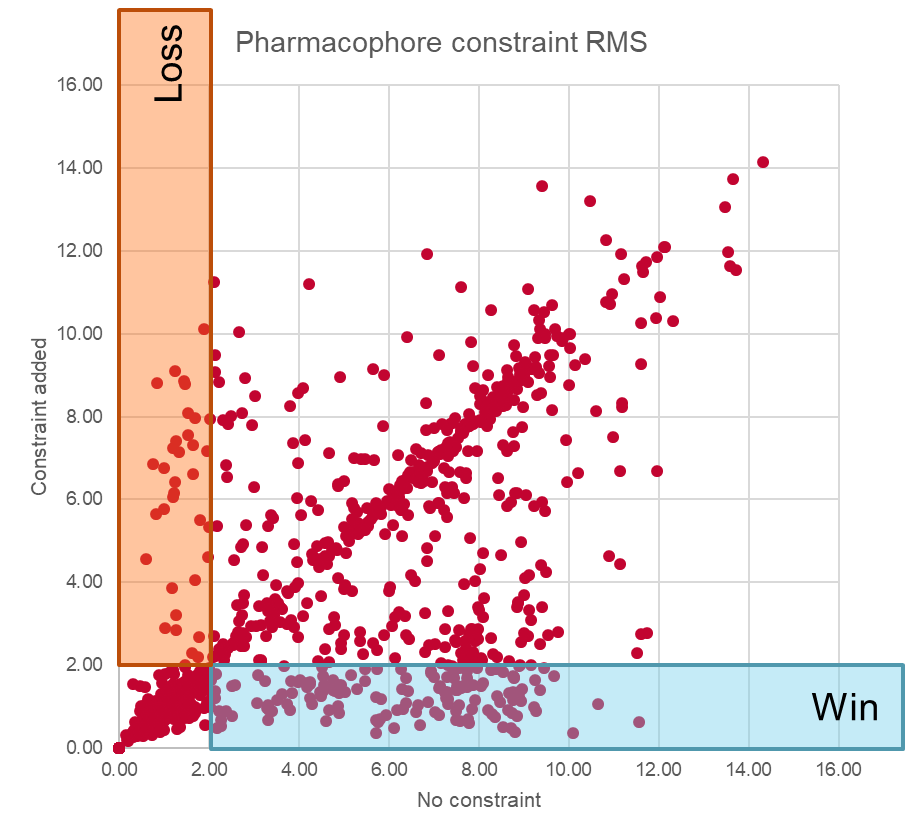
图3:使用药效团约束的分子叠合在4个激酶数据集上效果。通过添加约束改进了“Win”部分中的叠合,而“Loss”部分中的叠合则变得不正确。
让我们看几个例子。图4显示了一个案例,在对铰链结合片段添加约束之后使得原先不正确的叠合转换为正确的叠合。左边的无约束叠合结果将左边的二甲氧基苯环与右边的苯酚进行了非常完美的匹配,但是以产生铰链相互作用的喹唑啉氮为代价。在该氮上添加单个受体约束之后,最佳解决方案切换为满足约束的吲唑氮,这恰好是实验观察到的叠合。
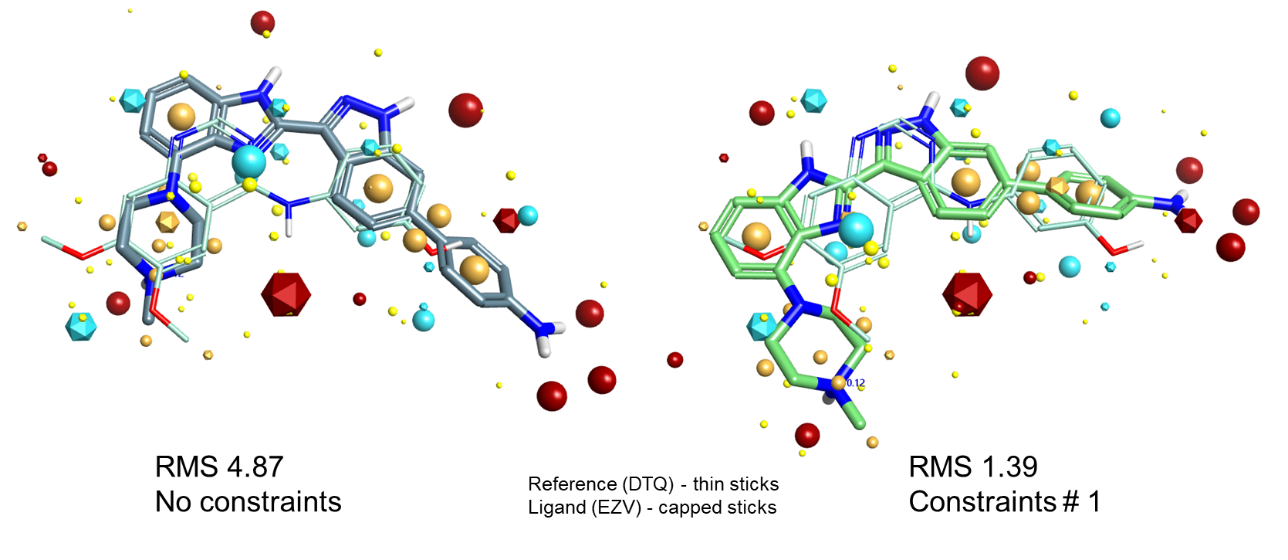
图4:CDK2数据集,将EZV叠合到DTQ
相似的,如图5所示,左侧显示了MTW与LZ8在原始形状和静电方面的最佳叠合方式。在MTW中与铰链区相互作用的2-氨基嘧啶与LZ8的吡唑、羰基片段匹配,但分子叠合的不是很好。然而,在叠合结果中,两个分子的苯环完美匹配。使用了氢键供体/受体药效团约束之后,会迫使叠合算法尝试更紧密地匹配2-氨基嘧啶,从而导致右侧的正确叠合结果。但是,请注意,苯环片段的叠合情况变地糟糕得多。
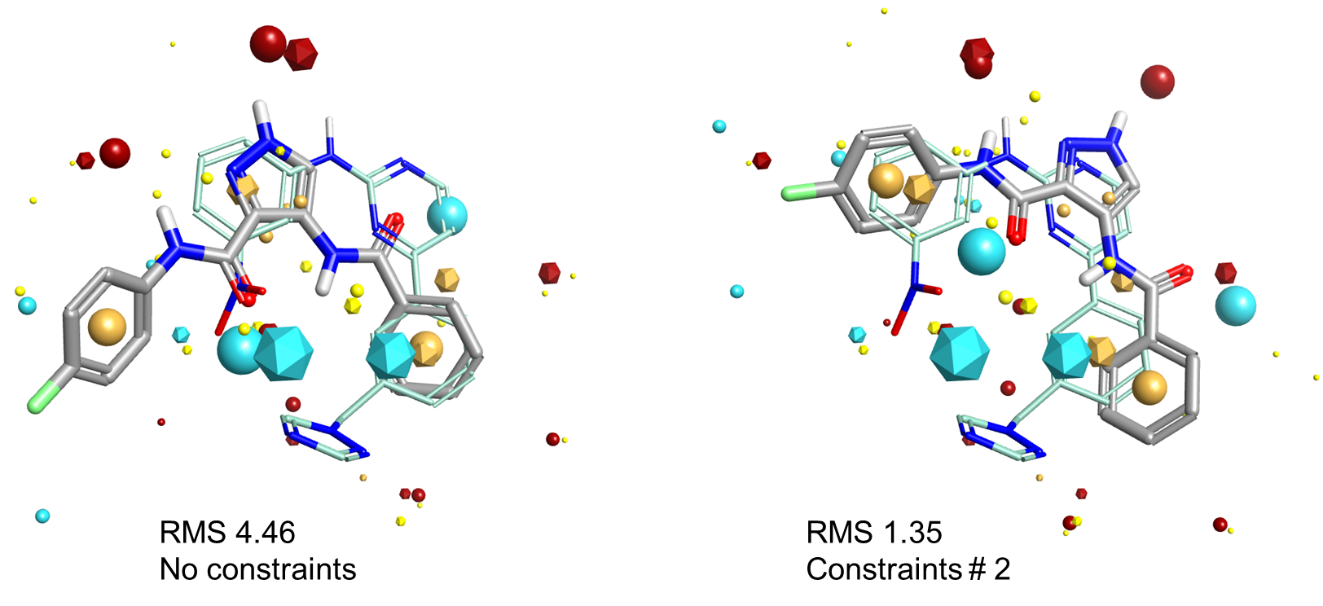
图5:CDK2数据集,将LZ8叠合到MTW
最后,图6显示了一个添加场约束导致将正确叠合结果转换为错误叠合结果的算例。当以DTQ作为参 比进行叠合时,如图4所示,场/形状叠合得到C94的正确叠合。但是,C94没有与我们在参比分子中设定约束的铰链形成氢键。该约束强制翻转叠合,以便其中一个磺酰胺氧与氢键受体满足匹配,从而迫使获得错误的答案。
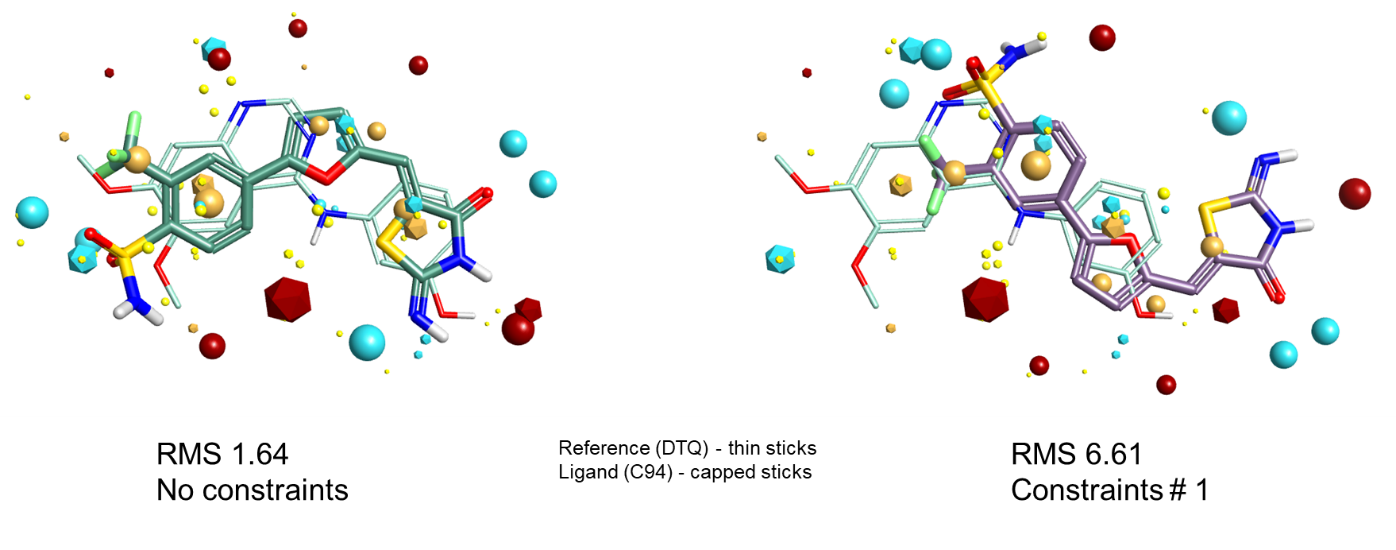
图6:CDK2数据集,将C94叠合到DTQ
如您所见,药效团约束非常有用。 如果您知道蛋白质需要特定的相互作用,您可以为我们的工具提供该信息以帮助他们找到正确的叠合方式。但是,必须牢记,通过添加这些约束,您也正在为实验引入偏好:您正在推动它提供您期望的答案。 有时,意想不到的答案竟然是正确的! 因此,我们建议谨慎使用药效团约束。我个人总是会运行一个不受约束的叠合实验作为对照,只是为了看看Forge(现在是Flare align)是否会找到一个我没有预料到但可能会阐明以前令人费解的SAR的叠合方式。
那么,什么时候应该使用场约束,什么时候应该使用药效团约束? 答案取决于您的要求和活性位点内的化学性质。 如果您确定必须保留药效团相互作用,那么使用药效团约束可能是合理的。 但是,如果相互作用方式并不总是以相同的形式出现,则场约束可能更合适。图7显示了一个BTK算例。左边的配体与主链吲唑的形成两个氢键。我们可能会想对供体和受体都添加药效团约束,除了已知的高活性配体会形成C-H氢键(见右侧的配体)。因此,如果需要约束,可能更合适的做法是向受体氮添加药效团约束,但使用场约束来指示NH/CH位置的供体偏好。
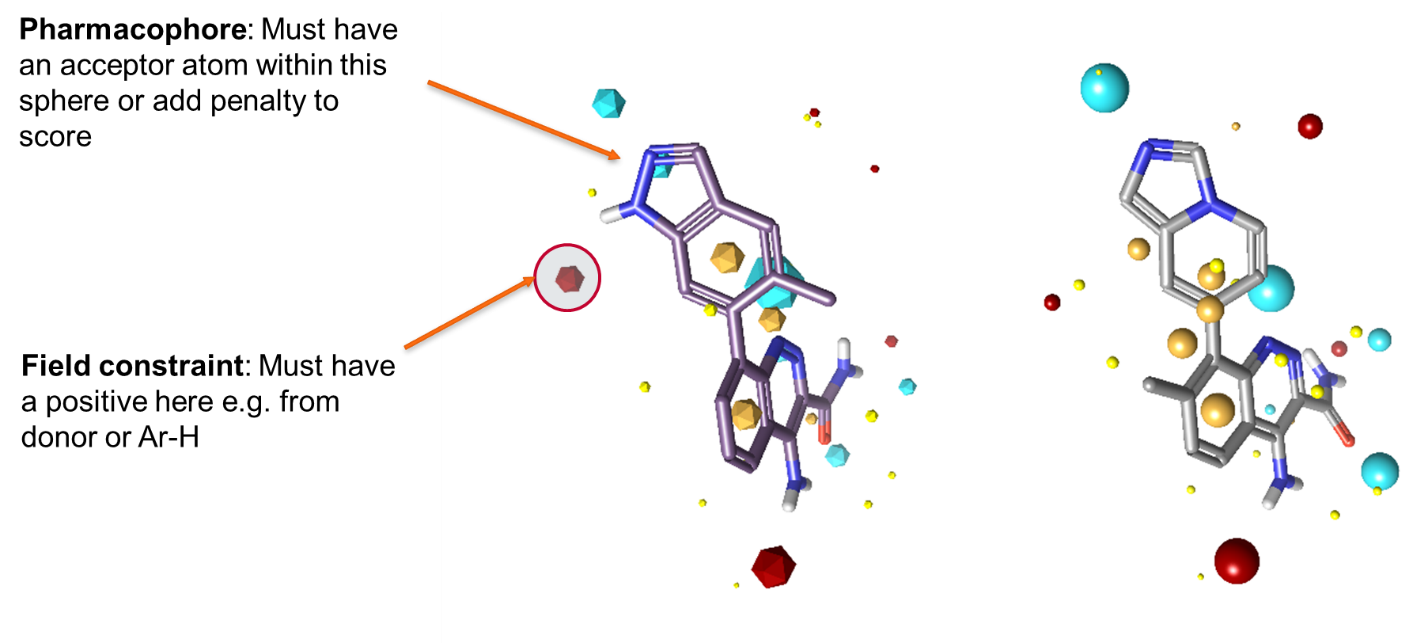
图7:BTK配体——我该用哪一种约束?
Cresset支持药效团约束与场约束的应用
cresset所有基于配体的计算化学应用均可使用药效团约束与场约束:
- Flare alignment:比较同系物、多样的活性化合物以理解SAR、构建模型与药效团
- Spark:为您的项目产生高度创新的创意,以探索化学空间并规避IP和毒性陷阱
- Blaze:高效的虚拟筛选已发现新的结构类型
文献
- Giangreco, I.; Cosgrove, D. A.; Packer, M. J. An Extensive and Diverse Set of Molecular Overlays for the Validation of Pharmacophore Programs. J. Chem. Inf. Model. 2013, 53 (4), 852–866. https://doi.org/10.1021/ci400020a.



