摘要:在本实验中,我们使用Spark生成新的PROTAC连接臂,然后用Flare中EC计算方法来评估这些新的PROTAC连接臂设计。我们发现了一种可能更好地结合于Brd4BD2-VHL复合物的连接臂。虽然这些结果没有经过生物学评估,但它们确实提供了潜在的可与蛋白复合物结合位点互补、结构多样的连接臂。此外,EC还可以用于研究结合位点中的蛋白-蛋白相互作用。
作者:Jessica Plescia, Stuart Firth-Clark, Mark Mackey, and Tim Cheeseright
单位:Cresset, Cambridgeshire, UK
原文:PROTAC Design Using Electrostatic Complementarity
前言
随着最近将靶向蛋白质降解作为药物发现的一种方法重新兴起,计算技术为设计蛋白质靶向嵌合体(PROTAC)这一具有挑战性的任务提供了一个有前景的解决方案。通过Cresset专有的静电互补性(Electrostatic Complementarity,EC)分析,该分析方法可从分子建模平台Flare中获得,当连接臂参与三元复合物的稳定化时,我们能够评估PROTAC结构与感兴趣蛋白靶标之间的互补性。在这篇海报中,我们说明了PROTAC结构的静电微小变化如何影响其对结合位点的互补性,并研究了修饰连接臂的方法。我们方法的关键是使用静电和形状相似性来确保潜在的连接臂替换物与靶蛋白保持有利的相互作用。
背景
Flare的EC功能利用配体和相关蛋白的静电作用来确定它们匹配的程度2。为了说明该功能在设计PROTAC连接臂中的实用性,我们会用到PROTAC MZ1,其靶向溴域和末端结构域(BET)蛋白,将Brd4BD2降解。特别是,MZ1与Brd4BD2-E3泛素连接酶VHL(von Hippel-Lindau肿瘤抑制蛋白)紧密结合,Kd = 3.7 nM。MZ1与Brd4BD2-VHL复合物的共结晶已被解释(PDB 5T35),如图1所示。
在本实验中,我们将用新片段代替PEG连接臂生成具有生物等排体意义相似性的PROTAC,同时还能提高与蛋白复合物结合位点的静电互补性(EC)。
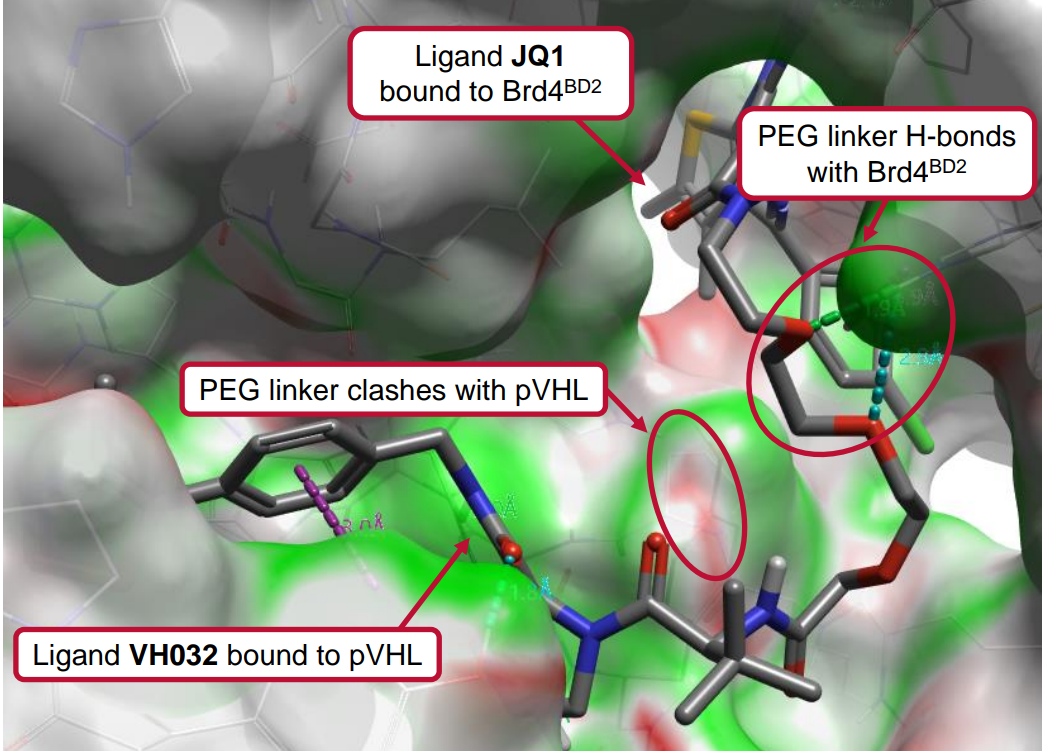
图1. PROTAC MZ1结合到Brd4BD2-VHL复合物结构里,其中蛋白表面根据静电互补性(EC)值进行着色。
方法
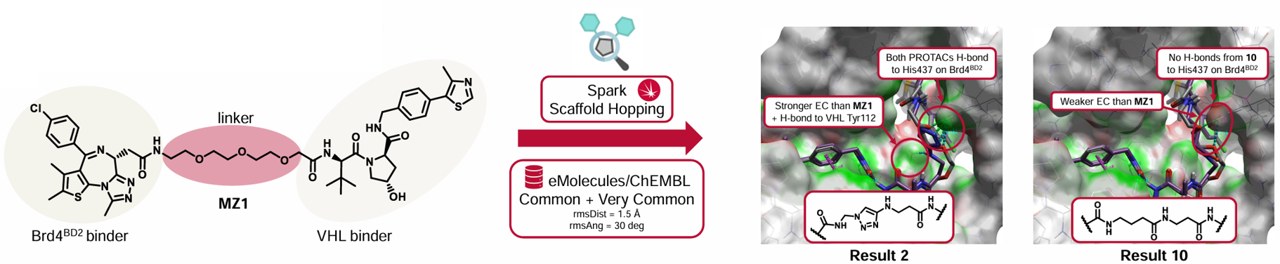
我们使用Spark的骨架跃迁工作流4来实现自动设计潜在的新连接臂,具体的Spark工作流如图2所示。
图2. 用Spark工作流设计新连接臂,接着用Flare进行打分。左:PROTAC MZ1的结构,其中要替换的连接臂片段用红色高亮显示。右:在Flare中可视化两个打分最靠前的结果(紫色),与灰色的MZ1叠合呈现。蛋白表面根据每个配体与Brd4BD2-VHL复合物之间的静电互补性(EC)打分值着色:绿色=好的静电互补性;红色=静电冲突。
将PROTAC MZ1上的PEG链确定为要被替换的“骨架”。然后,用Spark对数据库搜索,给出最终PROTAC结构,这些结构(1)与起始MZ1具有生物等排体意义上的相似性,并且(2)不会与周围的蛋白质发生冲突。将相似性打分排序最高的几个结果导出到Flare里,图2是用Flare渲染的结果2、10及其相关的EC表面。
结果
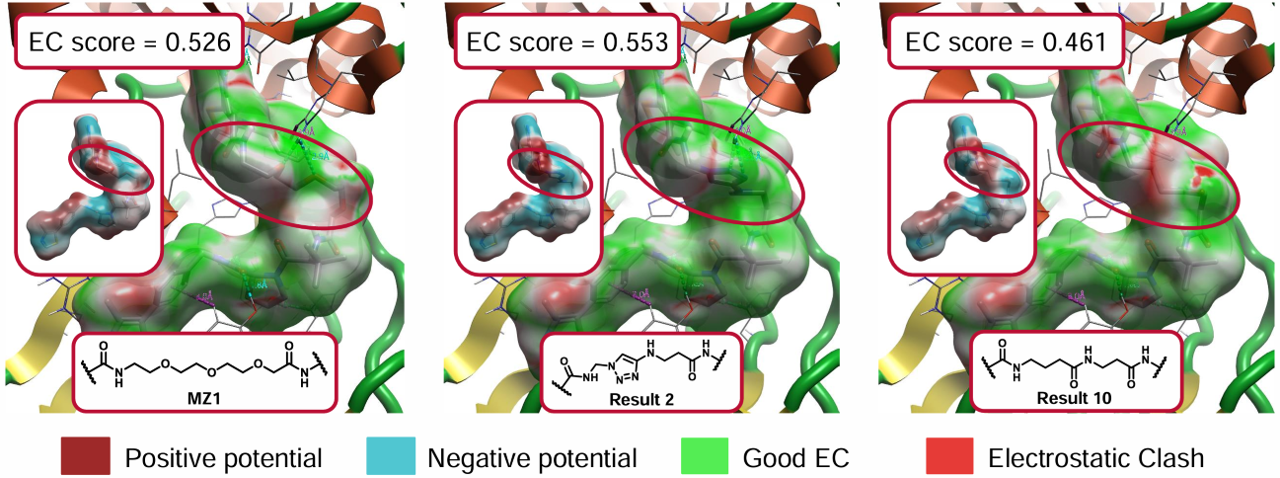
图3. 共晶MZ1以及两个Spark结果的ESP(红/蓝)与EC表面(绿/红) 及其EC打分。左:MZ1;中:Spark结果2;右:Spark结果10。圆圈高亮:连接臂。
Spark基于配体的搜索结果给出了一些令人感兴趣的MZ1 PEG链的类似物。其中最值得注意的是结果2和10(图2),它们都含有氢键供体,而不是PEG链中的氢键受体。然后使用Flare计算了设计的PROTAC的EC表面(图2和3)。三氮唑2能与Brd4BD2上的His437产生与PEG链相同的相互作用,与MZ1相比,EC进一步提高(见图1)。这表明新设计的连接臂具有不同的静电特性,是对PEG连接臂的改进。另一方面,酰胺链10与MZ1不同,它不与Brd4BD2形成氢键,与MZ1的EC相比,它与Brd4BD2有额外的冲突(见图1)。如果我们仔细观察并应用静电势(ESP)和EC表面到配体上,我们可以看到连接臂中的相似性和差异(图3)。虽然我们在观察ESP表面时只看到微小的差异,但它们在EC表面上更清楚地被识别出来。MZ1中的PEG链具有轻微的静电冲突,这似乎可以通过三氮唑2来解决。而酰胺链10与蛋白有明显的冲突。当我们计算每个PROTAC的EC打分时,它们与观察到的EC表面相匹配:MZ1和2相似,但2稍好一些,10是最差的且冲突最多。
结论
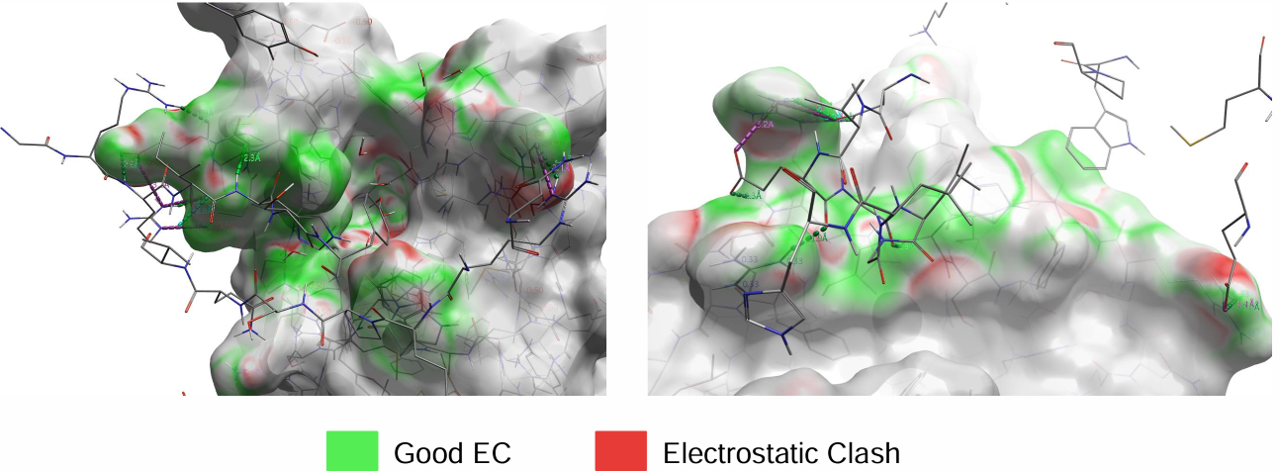
图4. 两个蛋白的EC表面。左:BRD4BD2的EC表面,VHL呈现为棒图;右:VHL的EC表面, Brd4BD2呈现为棒图。活性位点截止到6 Å。
在本实验中,我们用Flare中EC计算方法来评估新的PROTAC连接臂设计。使用Spark,我们发现了一种可能更好地结合于Brd4BD2-VHL复合物的连接臂。虽然这些结果没有经过生物学评估,但它们确实提供了潜在的可与蛋白复合物结合位点互补、结构多样的连接臂。EC还可以用于研究结合位点中的蛋白-蛋白相互作用。图4显示了Brd4BD2和VHL的EC表面。
参考文献
- https://www.cresset-group.com/software/flare
- Bauer, M. R. and Mackey, M. D. J Med Chem 2019, 62, 3036 -3050.
- Gadd, M. S. et al. Nat Chem Biol 2017, 13, 514-524.
- https://www.cresset-group.com/software/spark