摘要:本文介绍了西北农林科技大学现代药物研发团队2024年2月发表在《Journal of Hazardous Materials》(IF=12.2,中科院大类1区)上的关于蛋白质理性设计的研究工作。在该研究中,刘吉元教授等首次基于蛋白-配体的静电势互补(EC)技术,通过固定配体来对蛋白进行理性设计,大幅度提高了蛋白对配体的结合活性。该研究证明了EC技术在真实世界的蛋白工程应用中的重要影响。
原文:Matthew Kondal/2024-0-19
编译:肖高铿
前言
拟除虫菊酯(Pyrethroids)是一类常见的杀虫剂,用于作物和个人防护免受昆虫侵害。拟除虫菊酯的杀虫机制依赖于其对轴突的兴奋毒性,即它们会破坏电压门控钠通道,从而导致钠离子流入并使神经细胞永久去极化1。这就是为什么人们担心他们在环境中的积累,威胁人类和生态系统的健康。因此,生物干预措施正在积极开发中,以尽量减少对公众的风险,通过隔离这类化合物免受环境影响。
最近,西北农林科技大学的刘吉元教授课题组2探索了使用一种气味结合蛋白(OBP)从环境中去除拟除虫菊酯污染物的方法,具体来说,就是使用海灰翅夜蛾信息素结合蛋白1(Spodoptera littoralis pheromone binding protein 1,SlitPBP1)来吸附、去除拟除虫菊酯污染物。通过在工作流程中应用Cresset公司专有的电静互补性(Electrostatic Complementary™,EC)方法,课题组工程化了SlitPBP1突变体,使其能够高效地从不同环境介质中去除拟除虫菊酯2。
在本文中,我们将展示电静互补性(EC)在配体和蛋白设计中的强大力量,证明了EC在真实世界蛋白工程应用中的重要作用。
利用静电互补性量化蛋白质-配体有利的静电相互作用
静电相互作用是结合自由能焓态成分的关键贡献者,因此,在优化结合亲和力时,它是一个重要的考虑因素。静电互补性(EC)可快速量化并评估配体与结合口袋之间的静电匹配,从而帮助优化蛋白质-配体静电相互作用3。
静电互补性(EC)的计算方法是:比较蛋白质和配体在配体或蛋白质溶剂可达表面上标记出的顶点处产生的静电势。这些值在最大绝对值处被截断,求和并归一化到[-1, 1]范围内,其中:
- 打分为1的点:蛋白质和配体静电势大小相等、符号相反(完美静电互补性)
- 打分为-1的点:蛋白质和配体静电势大小相等、符号相同(完美静电冲突)
- 打分为0的点:蛋白质和/或配体静电势之一为零
EC同时使用多个打分(EC打分)来量化这种相互作用,包括EC、EC r 和 EC rho。EC打分是配体表面上互补性打分的归一化表面积分。EC r和EC rho分别是Pearson相关系数和Spearman秩相关系数,计算基于在配体和蛋白质表面顶点采样的静电势。这些后续打分可靠地估算了靶标结合位点中存在电荷各向异性情况下的静电互补性。无论使用哪种类型的打分,越接近1的EC分值指示了更有利的蛋白质-配体静电相互作用,从而意味着配体结合稳定性增强,活性提高。
假设在每个表面顶点(vertex)处计算的EC值介于-1至1之间,EC等值面也可以渲染在配体或蛋白质的溶剂可及表面上。绿色表示配体或蛋白质表面静电互补(打分为1)的区域,红色区域表示存在静电冲突(打分为-1)的区域,白色区域表示互补性既不有利、也不不利的区域(打分为0)。此等值面作为视觉辅助工具,指导研究人员关注需要重新工程设计以提高活性的配体或蛋白质部分(图1)。
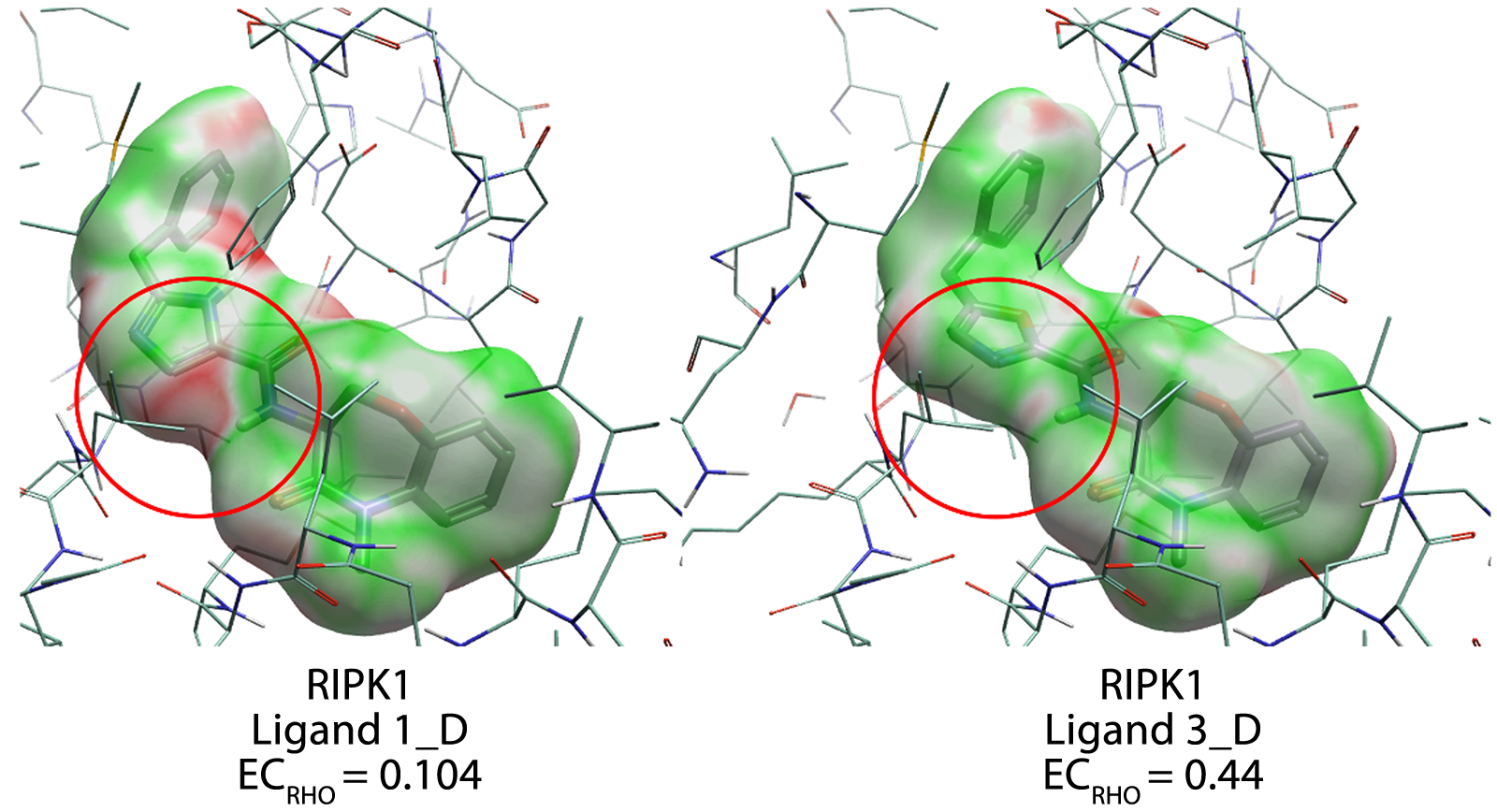
图1. RIPK1抑制剂(1_D和3_D)与RIPK1的静电互补性打分。红色圆圈高亮显示:配体1_D和3_D在RIPK1结合位点中静电互补性发生变化的区域。颜色编码:绿色为正值EC(静电互补),白色为0值EC(中性),红色为负值EC(静电冲突)。由Flare标识出的结合袋残基也进行了高亮显示。注意:本示例与论文中使用的示例不同。
利用静电互补性优化SlitPBP1对拟除虫菊酯的识别
通过降低湿实验验证阶段的高成本和漫长时间可以降低优化过程的研发费用。EC能够在计算模拟中识别出蛋白-配体之间能量不利的相互作用,从而找出可通过静电互补性优化来提升靶标结合力的结构片段。如下所示,本方法适用于“蛋白质”工程和“配体”工程两大领域。
Liu等人2的研究确实采用了一个多步骤的计算方法,包括同源建模(homology modeling)、分子对接(molecular docking)和分子动力学(MD)模拟,以获得拟除虫菊酯类杀虫剂delta-美昔丁(Deltamethrin,DeltaM)与SlitPBP1结合的复合结构。后续的残基自由能计算揭示了,结合位点里的谷氨酸残基Glu97(E97)对结合相互作用贡献了不利的自由能1.70 kcal/mol,从而将E97标记为候选残基,通过基因突变以改善与DeltaM亲和力。
将E97系统性地突变为其他19种天然氨基酸,并利用Flare™中的EC评估每个突变体的蛋白质-配体静电互补性。将E97突变为天冬酰氨酸(Asp,E97D)、苯丙氨酸(Phe,E97F)、天门冬氨酸(Asn,E97N)或组氨酸(His,E97H),均提高了EC值,同时没有引入其他不利的相互作用。与之不同,当将E97突变为苏氨酸(Thr,E97T)或色氨酸(Trp,E97W)时,观察到97位残基和DeltaM的末端苯环之间存在静电冲突。在EC计算的指导下,对SlitPBP1 E97N突变体进行了体外结合测验。结果证实了将E97突变为天冬氨酸(Asp)后确实提高了结合亲和力,解离常数(Kd)从野生型SlitPBP1与DeltaM之间的21.77 ± 1.41 μM降低到了SlitPBP1 E97N与DeltaM之间的1.07 ± 0.36 μM。
Liu等人2在确认SlitPBP1 E97N突变体对DeltaM的结合亲和力优于野生型后,重新审视系统,并重复每个残基的自由能计算。结果维持定义:任何对总结合自由能贡献超过1.00 kcal/mol的残基被视为不利的。尽管天冬酰氨酸106(Asp106,D106)在野生型SlitPBP1中有可接受的能量贡献,但在E97突变为Asn后,D106的能量贡献超过了阈值,变得不利,从而成为基因突变和蛋白质工程进一步优化的目标。如前所述,Liu等人2将D106突变为其他19种天然氨基酸,并利用Flare中的EC评估每个突变体的蛋白质-配体静电互补性。虽然EC打分表明D106W和D106E都是可行的突变,但在MD模拟中的RMSD显示D106E更加稳定。体外实验表明,表达的SlitPBP1-E97N与D106E双重突变体在结合亲和力方面比单一突变体和野生型有了显著改善,解离常数达到达到纳摩尔级别,Kd=0.77 ± 0.17 μM。
将SlitPBP1-E97N-D106E固定在固相载体表面后,其对不同水环境中的拟除虫菊酯类杀虫剂均表现出高效的吸附能力(\(吸附率﹥90%\)),最高吸附率达到99.35%。该技术对环境中拟除虫菊酯类杀虫剂的去除能力及对环境条件的适应能力远优于当前普遍使用的生物降解等技术,具有进一步推广应用的潜力。
结论
本文着重介绍了最近一个利用Cresset EC技术进行蛋白质工程的研究案例。Liu等人2展示了如何运用EC技术以便全面地理解OBP与DeltaM之间的静电相互作用,识别有利的蛋白突变,从而提高SlitPBP1对环境介质中拟除虫菊酯类物质的分离能力。
文献
- Hołyńska-Iwan, I. & Szewczyk-Golec, K. Pyrethroids: How They Affect Human and Animal Health? Medicina (Mex.) 56, 582 (2020).
- Liu, J., Li, Y., Wang, P., Zhang, Y. & Tian, Z. High-efficiency removal of pyrethroids using a redesigned odorant binding protein. J. Hazard. Mater. 463, (2024).
- Bauer, M. R. & Mackey, M. D. Electrostatic complementarity as a fast and effective tool to optimize binding and selectivity of protein-ligand complexes. J. Med. Chem. (2019).
联系我们
想要在自己的项目中使用EC技术,请联系我们(info@molcalx.com)获取免费的Flare 软件试用。



