摘要:药物与生物大分子之间的ΔG亲和力及其潜在的非共价相互作用在药物发现中起着至关重要的作用。可设计超分子复合物用于特定相互作用的识别和量化,包括对介质的依赖性;还能确保ΔΔG增量的可加性。此类分析有助于阐明分子间相互作用中的疏水效应。对于小的烷基而言,疏水效应几乎难以测量,但在存在弯曲表面的情况下,疏水效应会变得显著。这是因为在这些情况下,配体取代了缺乏氢键能力的水分子,从而导致了显著的焓增益(即释放较多能量)。在药物结合过程中,预测熵贡献(TΔS,即温度T乘以熵变ΔS)对自由能变化(ΔG)的具体影响是非常困难的,因为这种熵贡献的变化范围非常广泛,可以从5%到超过90%不等。这一点从已有的文献数据中可以明显看出。如通过多个药物复合物所示,许多所谓的“疏水效应”实际上涉及范德华或色散相互作用。利用对超分子卟啉复合物的测量,我们能够为许多基团推导出色散结合贡献,这些贡献与极化率具有相关性。因此,杂原子或π-电子体系总是导致增强的范德华贡献,而对于疏水效应,则预期会产生相反的结果。未来,通过扩展包含具有理想结合贡献基团的潜在配体的混合数据库,超分子复合物的结合贡献也可以帮助人工智能在药物发现中的应用。

原文:Schneider, H.-J. (2025) “Problematic Attributions of Entropic and Hydrophobic Effects in Drug Interactions,” ACS Bio & Med Chem Au [Preprint]. Available at: https://doi.org/10.1021/acsbiomedchemau.4c00148.
编译:肖高铿
前言
在药物设计和药物发现中关于非共价相互作用的讨论常常忽略熵效应和疏水效应或对其存在相互矛盾的解释。除了离子对之外,这两种贡献在水性环境中都起着重要作用,本文重点讨论了它们可能的结合机制。药物与生物受体的结合强度对药物的有效性起着重要作用,这种结合强度通常用相互作用能自由能(ΔG)来定义,尤其是在多个结合位点的体系(multivalent systems)中,多个结合位点的存在可以增强亲和力1-6。其他重要因素,如药物溶解度和药物透过生物屏障的能力,可以通过特定参数进行量化,例如Abraham、Raevsky等人根据分配系数或气-液分配系数推导出的氢键酸度值和氢键碱度值进行有效地量化7-10。在质子性溶剂(例如水溶液)中氢键作用较弱,因此我们在此仅讨论熵效应、疏水效应以及范德华力或色散效应,除了离子对之外,这些效应是在水溶液中相互作用的决定因素。
近几十年,基于超分子复合物(见表S1)对潜在非共价相互作用的经验评估取得了显著进展,在不同的介质中,特定相互作用的性质和数量(n)可以进行系统地变化和研究11-12。如支持信息(图S1–S5)所示,通常可以观察到测量到的总ΔG值与数量(n)之间存在线性相关性,这种线性关系使得我们可以推导出特定相互作用能量的单个值,并确保单个ΔΔG值的加和性13。长期以来,Hammett14通过线性自由能相关性建立了相同的策略,在这种方法中,反应活性值(reactivity values)是通过取代基效应(substituent effects)推导出来的。与Hammett型关系类似,在分子内非共价相互作用的分析中也观察到15在不同的模型体系中可加和性的ΔΔG值是相似且可加的,而TΔS(熵贡献)和ΔH(焓贡献)的值则不然。对于最重要的非共价相互作用,其亲和力ΔG值可以从超分子复合物的许多平衡测量中获得16;这些ΔG值可用于新药的设计以及潜在相互作用机制的研究。
熵效应
一个主要且至今尚未完全解决的问题是熵因素(TΔS)对总亲和力(ΔG)的贡献3,实验测量表明,在超分子复合物中,熵因素对总ΔG值的贡献比例在5%至90%之间变化17,这些超分子包括超分子复合物、离子载体18或环糊精19。药物与生物聚合物20−24的相互作用表现出更大的多样性22,23,25,这种多样性通过广泛的测量得以展示,如表1所示22。计算配体与蛋白质结合过程中熵贡献的方法,必须考虑到水合效应20,21,26,27、相互作用能量的波动以及生物聚合物的柔性等关键因素,但与实验测得的TΔS和ΔH值仍然存在较大差异28。值得注意的是,人们发现药物与生物聚合物在结合过程中的ΔH和TΔS贡献具有显著的温度依赖性22。等温滴定量热法(ITC)已成为一种前景广阔的药物结合分析工具,但其应用仍然不够广泛22,29。如表1所示22,药物与生物聚合物的相互作用可以是焓驱动或熵驱动的,而超分子复合物主要表现出不利的TΔS(熵)贡献,但是盐桥是例外。如果相互作用机制相似和/或受体性质相似(例如环糊精),则在ΔH和TΔS之间会观察到相当线性的相关性。关于ΔH(焓变)与TΔS(温度乘以熵变)之间的补偿效应,已经提出了多种解释30。从直观上看,强结合力(ΔH)通常会导致分子的柔性降低或自由度减少。然而,这种补偿效应的普遍性也被某些研究者质疑,甚至将其描述为“虚幻的”(phantom)31。
表1. 通过等温滴定量热法(ITC)测量的药物与生物聚合物(Biopolymers)相互作用的选定热力学参数 (22)a
| T (K) | ΔH (kJ mol-1) | TΔS (kJ mol-1) | ΔG (kJ mol-1) | |
|---|---|---|---|---|
| (1) NOF with HSA | 288 | -15.0 | 11.4 | -26.4 |
| (2) 3HF with HSA | 293 | -95.1 | -72.5 | -22.6 |
| (3) NHM with DNA | 288 | -3.9 | 20.6 | -24.5 |
| (4) NHM with RNA | 293 | 1.3 | 33.7 | -32.4 |
| (5) CRYP with RNA | 288 | -11.1 | 9.45 | -20.5 |
a(1)吲哚喹啉生物碱(NOF)与人血清白蛋白;(2)3-羟基黄酮(3HF)与人血清白蛋白;(3)β-咔啉药物norharmane(NHM)与DNA;(4)β-咔啉药物(NHM)与RNA;(5)cyrptolepine(CRYP)与RNA。
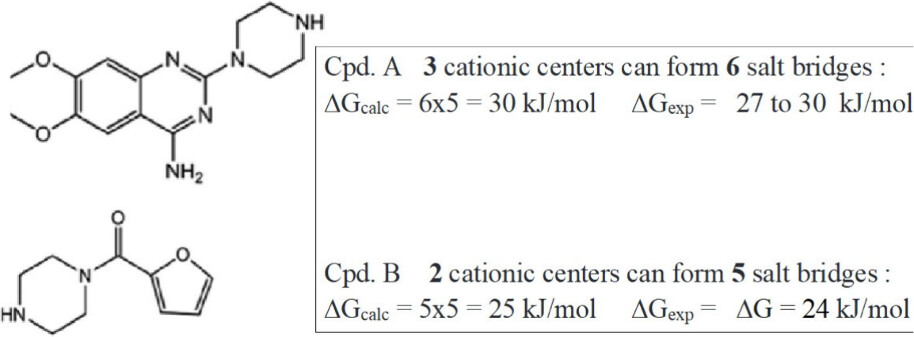
由N-苯基哌嗪衍生的药物与α-1-肾上腺素受体蛋白相互作用的例子展示了一种不同寻常的现象,即其主要驱动力是较大的正值熵贡献,同时伴随着较小甚至吸热的焓值(endothermic enthalpy values)。这也是一个应用超分子复合物衍生的ΔΔG自由能增量来替代性预测总亲和力的例子。观察到的\(ΔH^θ < 0\)(标准焓变小于零)和\(ΔS^θ > 0\)(标准熵变大于零)被归因于静电作用力是结合的主要因素32。然而,药物中带有咪基的嘧啶环呈现出强碱性,与质子化哌嗪片段的结合,为A型的配体(Scheme 1)提供了三种阳离子中心,从而与蛋白质中的天冬氨酸Asp形成3 × 2 = 6个盐桥,这些盐桥对结合自由能的贡献值为ΔΔG值为5 ± 1 kJ/mol(图S1、S2、S3)。在中等离子强度的水溶液中,预期具有特定结构特征(如含有嘧啶环并能形成三个阳离子中心)的药物分子与靶标蛋白质之间的结合亲和力值为ΔG = 6×5 = 30 kJ/mol33。这个预测值与实验测得的27~30 kJ/mol的自由能值非常接近,这些实验数据是针对编号1至6的衍生物得到的。而缺少嘧啶单元的B型配体,正如预期的那样,显示出较低的亲和力,其ΔG = 24 kJ/mol。显然,热力学数据表明,离子对或盐桥是主要的结合因素,这与由静电作用引起的络合作用形成对比。而后者,基于氢键或供体-受体相互作用的结合机制,通常是由焓(ΔH)驱动的,并且往往伴随着不利的熵(ΔS)因素,这一点早已为人所知。
Scheme 1. N-苯基哌嗪衍生物药物32与α-1-肾上腺素受体蛋白天冬氨酸残基形成的盐桥
疏水效应和色散相互作用的对比与区别
在讨论药物相互作用时,疏水效应22,34-37的引用频次高于范德华力或色散力38-54,关于后者的研究还涉及药物递送和药代动力学。有人指出,虽然色散相互作用在模型系统中得到了很好的理解,但目前尚无法对蛋白质相互作用进行相应的计算测试55。在肽类与溶剂系统的分子动力学模拟中,忽略氢键相互作用而仅基于色散相互作用,发现肽也能折叠成螺旋和发夹状结构56。近年来,人们发现特殊的二级结构相互作用会影响蛋白质折叠57。此类相互作用包括C–H···O氢键,n→π*相互作用,卤键和硫键,以及涉及芳烃的相互作用,实际上这些都是色散性质的相互作用。
在水介质中,疏水效应和色散相互作用都可以发挥重要作用。由于水分子极化率较低,这两种相互作用通常被笼统地归类为“疏水效应”,但实际上它们之间的区别绝不仅仅是语义上的问题。实际上,疏水相互作用和色散相互作用指的是完全相反的相互作用机制,这一点可以从相似大小的烷烃和寡肽在水中的溶解度差异中明显看出。由于寡肽中含有更多可极化的酰胺基团,它们能够进行色散相互作用,而烷烃则不能。
在生物医学文献中,研究人员利用多种方法来表征和量化疏水相互作用,并根据这些研究建立了不同的疏水性量化标准58。Wolfenden 等人基于氨基酸侧链的小分子类似物在水和环己烷之间的分配情况,开发了早期的疏水性量化标准59,60。White开发了一种基于肽的系统61,使用传统的水和1-辛醇分配系数62,用于研究侧链和脂质之间的相互作用。其他方法则使用与亲脂性膜的相互作用作为疏水性模型63。人们发现药物与血清白蛋白的结合强度与其疏水性密切相关64,这种现象归因于药物使蛋白质结合位点去溶剂化(desolvate)的能力65。
用超分子复合物区分疏水和色散相互作用:非经典疏水效应
对水溶性卟啉作为受体的超分子复合物中平衡常数的测量,使研究人员能够清晰地区分疏水效应和色散相互作用66。诸如丙基之类的烷基对疏水性卟啉表面表现出可以忽略不计的亲和力,环己基的亲合力贡献小于 ΔG = 1 kJ/mol,而单个苯基则表现出 ΔG = 8 kJ/mol 的亲和力,诸如五甘氨酸之类的小肽也能达到了相似的亲和力值17。由于烷烃对疏水表面的亲和力几乎可以忽略不计,这使得我们能够通过数百个平衡数据点来量化不同官能团的色散贡献。正如预期的那样,这些数据点显示出与相应极化率值之间存在大致线性的相关性。
烷基与平面型的卟啉表面之间缺乏疏水相互作用,这表明在这种特定情况下,这种吸引性的疏水力并不存在,但这并不意味着疏水效应在一般情况下不起作用。如果疏水表面不是平坦的而是弯曲的,那么疏水相互作用可以变得非常显著;在这样的表面上相应的凹陷处,水分子的数量可能少于其形成最优氢键网络所需的数量。通过合适的客体分子替换那些处于高能状态且氢键网络受阻的水分子,可以导致显著的亲和力增加67,68,这种现象通常伴随着显著的焓增(见图1)21,69,70。这种由焓驱动且伴随着热容降低的疏水结合通常被描述为非经典效应,与经典的疏水效应模型形成对比。经典的疏水效应模型认为疏水作用主要由熵贡献的变化驱动,并且通常伴随着热容的负变化(即热容减少)71-75。经典效应体现在简单气体和碳氢化合物在水中的溶解过程中,这类过程通常是放热的(即释放热量),但熵不利(即熵减少)。而非经典效应则表现为非极性口袋和腔穴中缺乏氢键或高能水分子的吸热水合(即吸收热量)76-78。
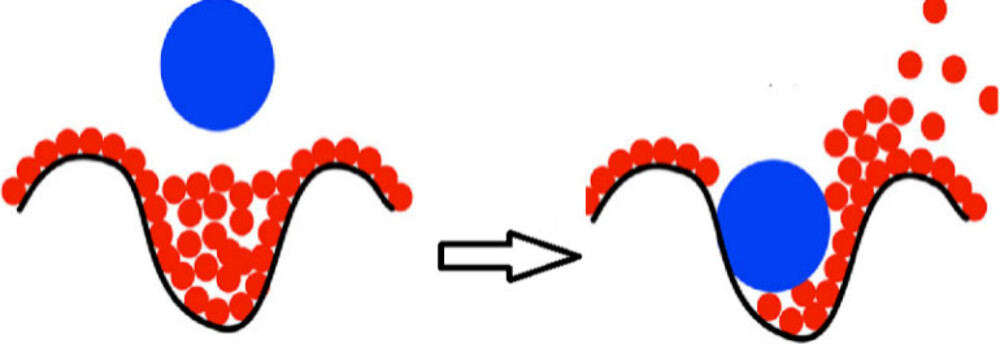
图1. 通过用配体替换氢键缺陷的高能水分子所产生的非经典疏水效应。经授权改编自参考文献21。版权 © 2019 归美国化学会所有。
计算色散效应的一个难题在于,诸如酰胺之类官能团的极化率数值并不是简单地由其组成原子的极化率相加得到的79。然而,使用卟啉作为模型进行实验测量的数据表明,酰胺具有显著的极化率值,这些值对肽和蛋白质的相互作用有重要影响。为酰胺官能团开发了适合的增量参数,用于肽和蛋白质的力场计算80,81;通过与气相或晶体结构、振动光谱以及晶体升华热的比较,先进的MM4力场取得了成功的测试82。AMBER力场结合分子动力学(MD)模拟,也用于研究蛋白质中的范德华相互作用,此种方法基于含有相应基团的小分子的实验汽化焓和液体密度数据83。
药物复合物中疏水效应或色散贡献的例子
大多数关于药物与蛋白质之间非共价相互作用的文献将这些相互作用主要归因于疏水效应,而较少将其归因于范德华力或色散相互作用作为决定性因素。然而,在HIV-1蛋白酶的耐药突变研究中,范德华相互作用也被认为存在于氨基酸的烷基残基之间的相互作用中84。伯醇与主要尿蛋白(major urinary protein, MUP)的结合特性表现为随着醇链长度增加,焓变(ΔH)增加,而TΔS(熵变乘以温度)贡献减少。这两个参数的线性依赖关系被归因于有利的色散蛋白-配体相互作用85。
当疏水药物布洛芬结合于溶菌酶(作为蛋白质模型)时,与溶菌酶氨基酸如色氨酸(TRP)、异亮氨酸(ILE)和丙氨酸(ALA)的相互作用主要归因于占主导地位的疏水效应(见图2)。具体来说,布洛芬与溶菌酶之间共有13个疏水相互作用,包括与TRP62(三个)、TRP63(四个)、TRP108(两个)、ILE98(两个)的相互作用,以及与ILE58和ALA107的单一结合,此外,还与天冬酰胺(ASN59)发生的少量氢键相互作用86。然而,预计至少TRP61和TRP62与布洛芬芳环之间的π-π堆积产生的色散贡献将提供大约ΔG = 2 × 8 = 约16 kJ/mol的结合自由能,而与ASN59和GLU53形成的氢键可以贡献至少10 kJ/mol。因此,总的结合自由能(ΔG)值可达至少25 kJ/mol,这与实验值相当接近。值得注意的是,布洛芬与溶菌酶的结合随温度升高而增加。这不仅与疏水效应相符,也与相互作用的色散性质一致。
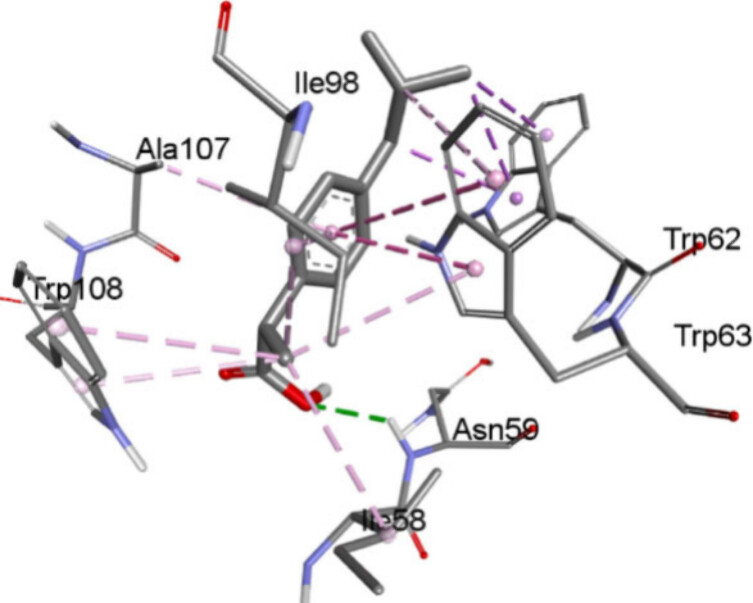
图2. 布洛芬与作为蛋白质模型的溶菌酶对接示意图,其中相互作用归因于疏水力;ΔG = 23.4 kJ/mol。经授权改编自参考文献86。版权2023归Elsevier所有。
更具亲水性的对乙酰氨基酚(paracetamol)与蛋白的结合强度随温度升高而减弱,这与该化合物主要通过氢键相互作用的发现相一致。结合能是通过基于相互作用残基的溶剂可及表面积(Accessible Surface Area, ASA)进行对接计算而得到,并且与实验数据吻合良好,这似乎表明占主导地位的是疏水相互作用。然而,苯基的尺寸和极化率类似于环己基等基团,这意味着基于色散相互作用的计算可能获得相似的相互作用。
一个被描述为主要以色散相互作用为主的例子是蛋白质合成酶与氨基噻唑抑制剂之间的结合,其结合亲和力为25 μM,此结合不仅包括抑制剂与蛋氨酸(Met138)之间的芳基···S色散相互作用,还包括抑制剂的苯环与Ala162和Cys163骨架酰胺基团之间的堆积作用87。图3说明了硫和酰胺基团与芳香基团的相互作用。
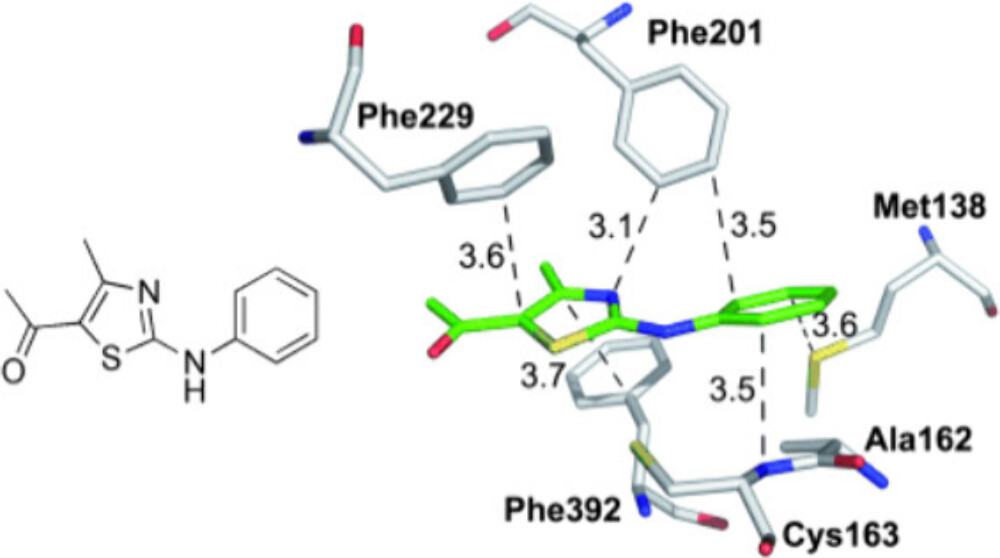
图3. 氨基噻唑抑制剂在蛋白质中起主导作用的色散相互作用。典型距离以Å为单位(基于X-衍射结构,分辨率1.35 Å,PDB 2VBA)。经授权改编自参考文献87。版权2011归Wiley VCH所有。
在一项针对乙基哌啶碘化物作为烟碱型乙酰胆碱受体蛋白拮抗剂的研究中88,除了阳离子-π相互作用外,还考虑了范德华力的作用,但没有考虑疏水效应,见图4。图3中的拮抗剂表现出高达36 kJ/mol的结合亲和力,相比之下,胆碱(choline)的结合亲和力仅为16 kJ/mol。这种高亲和力归因于拮抗剂与酪氨酸(Y91、Y187、Y194)和色氨酸(W147、W58)的芳环之间的阳离子-π相互作用,以及与亮氨酸(L106)和谷氨酰胺(Q115)之间的范德华力相互作用。亮氨酸(L106)的脂肪链与拮抗剂之间的相互作用更倾向于归因于疏水效应,尤其是考虑到观察到的与烷基链长度相关的依赖性;而与谷氨酰胺(Q115)的相互作用则预计主要由色散力引起,因为酰胺官能团对这种相互作用有相对较大的贡献66。
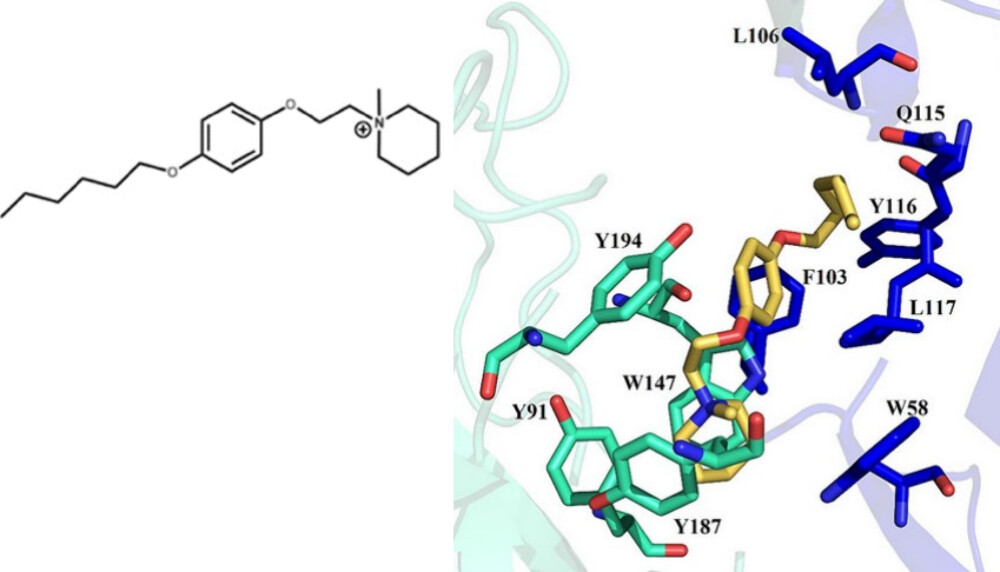
图4. 甲基哌啶碘化物拮抗剂(黄色)与烟碱型乙酰胆碱受体蛋白的相互作用;有关说明请参见正文。改编自参考文献88。版权2018归Frontiers所有,采用知识共享署名许可协议(CC BY)。
不同苯基乙酰胺与丝氨酸蛋白酶因子的结合被明确归因于色散主导的贡献,特别是考虑到在苯环对位(p-位)引入卤素取代基时结合亲和力的增加。具体来说,当R = Br、Cl 时,抑制作用相比R = H时增加了10.5 kJ/mol,而当R = F时,抑制作用仅增加了3.5 kJ/mol。在MP2水平上进行的量子力学计算以及晶体数据库的搜索分析表明,均未发现分子间相互作用存在明显的方向性取向,这一结果进一步支持了色散力在这种相互作用中的主导地位。
肽的折叠作为研究蛋白质折叠的一种有效模型,它为理解蛋白质折叠中的主要贡献提供了更直接的方法89,90。一种特殊的肽43,其仅具有亲脂侧链氨基酸,这显然表明其主要依赖疏水相互作用而非色散相互作用。折叠的驱动力不一定是氨基酸烷基之间的吸引力,也可能是由于肽开放结构上存在高能的水分子。
带有卤素取代基的苯丙氨酸α-发夹肽(图5)的展开实验显示,发夹结构的稳定性随着卤素原子的不同而增加,顺序为F(0.5)\(<\) Cl(1.42)\(<\) Br(1.97)\(<\) I(2.26),所有数字均为kJ/mol的ΔΔG值91,这是非常明确的色散相互作用证据。
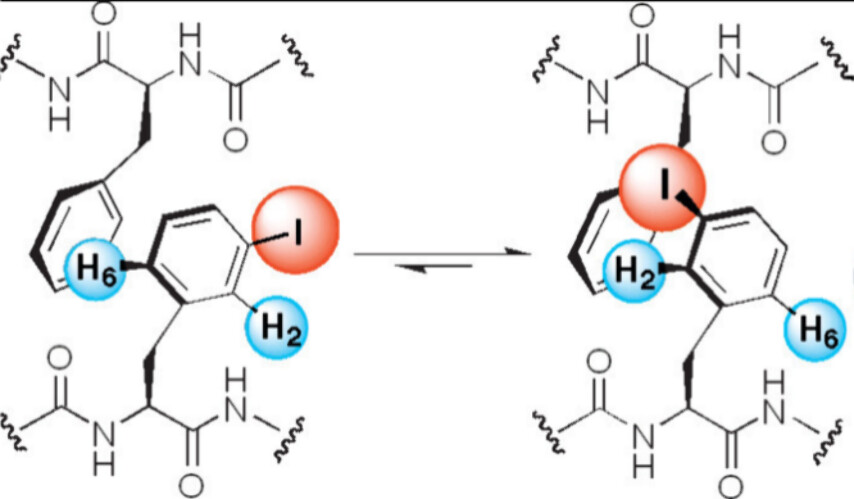
图5. 碘-芳基色散相互作用对肽发夹的稳定化作用。经授权改编自参考文献91。版权2004归美国化学会所有。
结论
熵(TΔS)对分子间结合自由能(ΔG)的贡献可以高达90%,并且具有温度依赖性;以熵驱动的复合过程伴随着非常小甚至不利的焓(ΔH)贡献,这表明离子对作用占主导地位。药物的非共价相互作用通常归因于疏水效应,而色散或范德华相互作用常常被忽视。经典的疏水相互作用主要由熵(增)驱动,而非经典的疏水因素则可能涉及焓的显著贡献,这通常是由于受体结合位点中存在的高能水分子(被置换或重新排列所致)。然而,大多数药物和所有生物聚合物(Biopolymer)总是包含一些元素,至少是杂原子或含π键,这些元素会降低疏水性,并导致显著的极化率,因此往往会引发色散相互作用,而不是疏水相互作用。核酸,特别是其核碱基和桥接片段中的杂原子提供了许多官能团,使其成为色散相互作用的理想候选者。肽和蛋白质不可避免地包含许多酰胺基团;单个酰胺基团本身就表现出与碘或硫基团相近的色散相互作用能增量;含有芳环、硫或氧元素的侧链进一步增加了色散贡献。寡肽(oligopeptides)与其它分子之间的色散相互作用亲和力,简单地对应于其酰胺基团数量的总和。
大多数药物含有能够参与色散相互作用的元素,通过使用卟啉模型进行测量,可以从中推导出结合亲和力的增量。经典的疏水效应在小烷基和平坦的受体表面(如芳环)之间几乎无法测量出来。非经典的疏水效应迄今为止主要被归因于焓驱动的相互作用;这种效应可以在受体表面缺乏足够氢键的情况下,通过高能水分子的存在而显现出来。
人工智能在药物发现中作用日益增加92,93;混合数据库可用于从头药物设计94,并可用于评估的药物亲和力值95。混合人工智能(AI)方法通过引入大量含有可经验预测非共价相互作用基团的未知结构,显著扩展了一个假设数据库。合适的基团可以通过分析超分子复合物的实验1,6,17(见图S1–S5)以及查阅氢键结合的表格数据来选取7-9。
原创文章,作者:小墨,如若转载,请注明出处:《药物相互作用中熵和疏水效应的归因性解释》http://blog.molcalx.com.cn/2025/04/23/entropic-and-hydrophobic-effects-in-drug-interactions.html



