摘要:Flare™是我们功能最丰富的软件平台,每年两次更新以响应客户的反馈,并为用户提供最新的计算化学方法。随着我们热切期待的春季发布即将到来,软件开发团队目前正在为平台的第7版做最后的润色。在发布之前,让我们一起看看Cresset基于配体和基于结构的分子建模平台中的一些新功能和改进。
更高效的计算
在Flare V7中,您能够并行运行多个作业,没有必要等到一项工作完成后再开始新的工作。
例如,您可以从RCSB下载并准备一份蛋白质列表,然后下载其它的蛋白列表,而无需等待第一份蛋白质准备完成。类似地,您将能够一次启动多个对接或分子叠合实验,每个实验可使用稍微不同的参数,一旦本地或远程资源可用,就会对这些对接或叠合实验按先来后到进行排队处理。
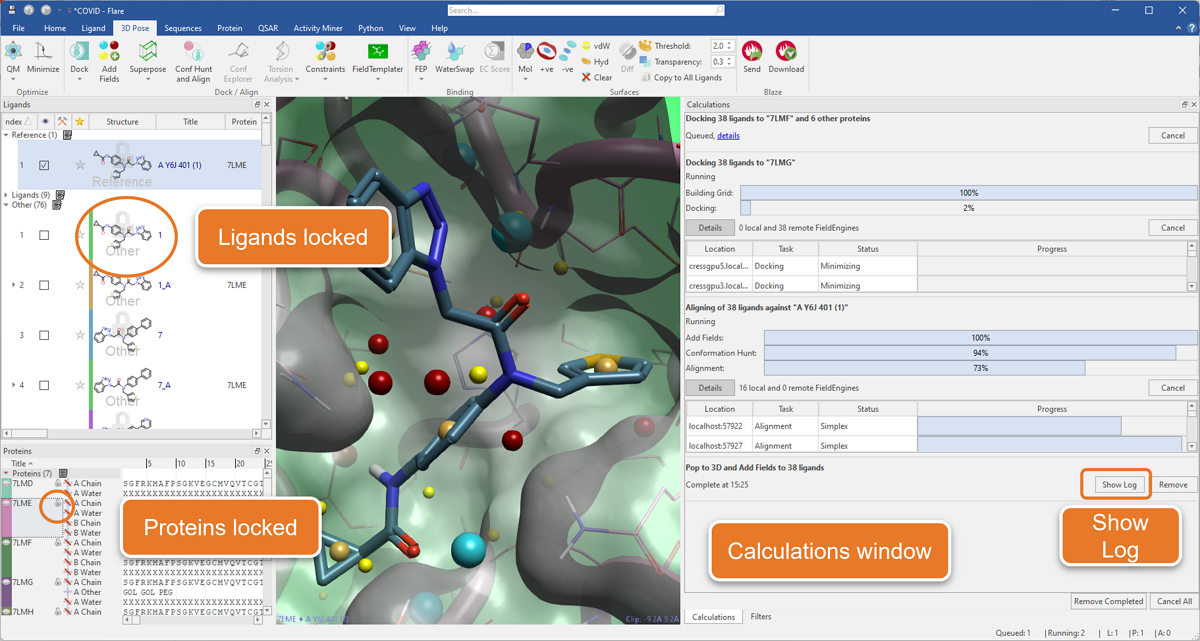
智能锁定系统可防止您无意删除或修改运行作业中使用的配体和蛋白,直至完成。此外,重新设计的计算窗口(图1)监视所有正在运行、排队和已完成的作业,使您可以轻松访问每次计算的日志。
图1. 新“Calculation”窗口可监控Flare中多个作业
系综共价对接:在共价对接实验中考虑蛋白的柔性
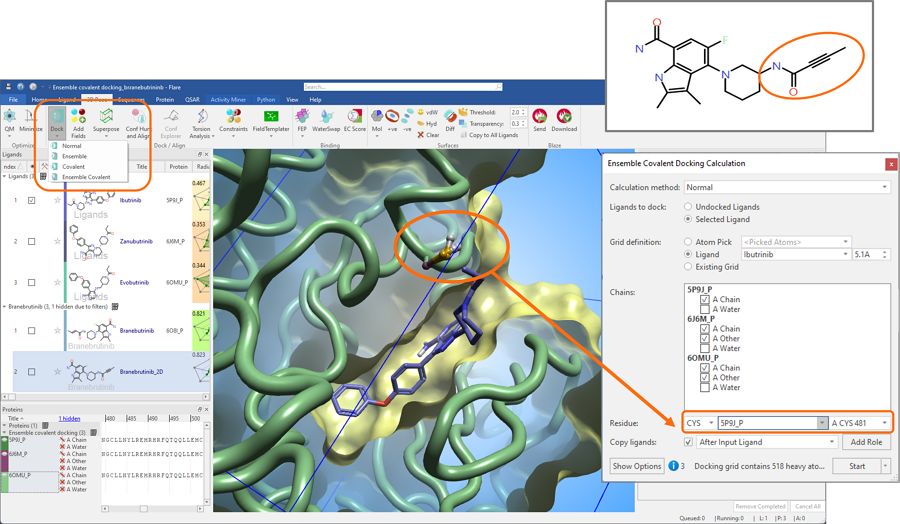
在Flare V7中,我们将系综对接合共价对接两种流行的方法合并,并进一步扩展了对接工作流程以实现系综共价对接计算(图2)。
只要你想在共价对接实验中考虑蛋白的柔性,你就可以使用这种新方法,在单个共价对接过程中包括同一蛋白质的多个可选的活性位点构象。蛋白构象系综还可以通过实验得到,也可以从其他来源收集,比如分子动力学研究。
在图2所示的例子中,将Branebrutinib炔酰胺共价弹头(见2D结构橙色圆圈)对接到Bruton酪氨酸激酶(BTK)三种不同构象的活性位点中,该活性位点与共价抑制剂Ibrutinib(PDB 5PJ9)、Zanubrutinib(PDB 6J6M)和Evobrutinib(PDB 6BOMU)结合。在开始实验之前,在Flare中仔细地准备这三个蛋白结构并叠合在一起。
图2. 将Branebrutinib共价对接到三种不同构象的BTK活性位点
使用PDB 5PJ9中共晶的Ibrutinib来定义对接网格,并将准备好的5PJ9蛋白结构中的CYS481作为共价残基。叠合到5PJ9上的6OMU和6J6M结构中的等效共价残基由Flare自动检测。
结果(图3)表明,共价对接工作流程能够识别出Branebrutinib(绿色)与BTK结合的正确结合模式,并与PDB 6O8I的共晶配体(紫色)结合模式非常相似。
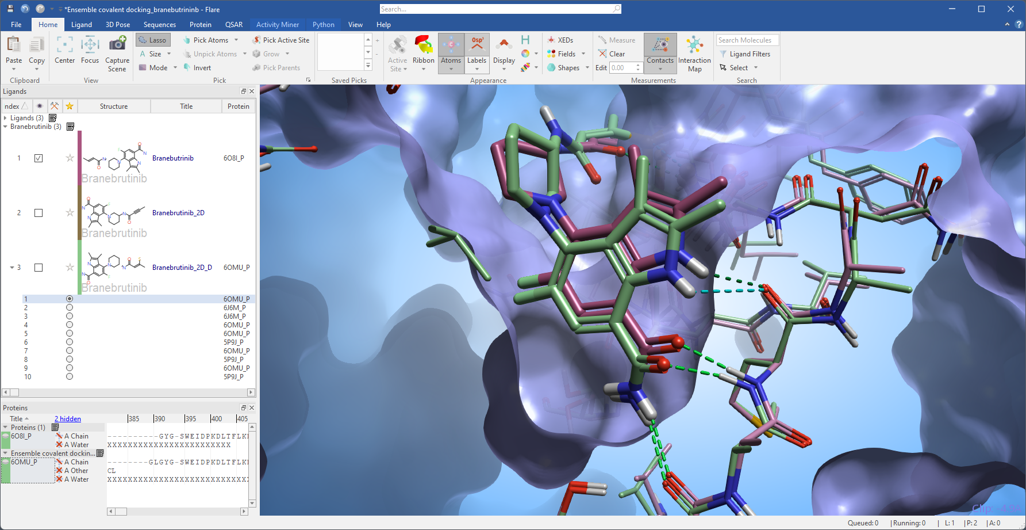
图3. 系综共价对接工作流程识别出Branebrutinib对接在6OMU_P(绿色配体和蛋白质)中的结合模式,该结合模式与PDB 6O8I的晶体学结合模式(紫色配体和蛋白)非常相似。
此外,对于Flare中的所有对接方法,现在可以指定活性位点中的哪些氢键供体蛋白残基(从丝氨酸/Serine、苏氨酸/Threonine、酪氨酸/Tyrosine和赖氨酸/Lysine选择一个或全部选中)在对接实验期间可以旋转(图4)。这提供了另一种可以在对接实验中实现侧链柔性的方法,并实现与蛋白质活性位点的最佳相互作用。
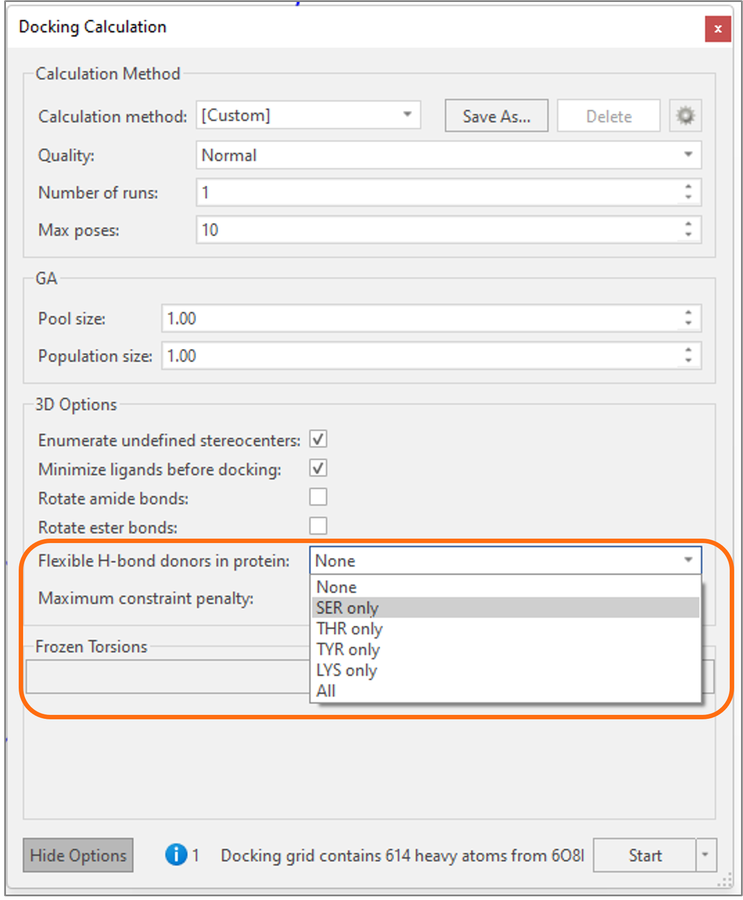
图4. 对于丝氨酸/Serine、苏氨酸/Threonine、酪氨酸/Tyrosine与赖氨酸/Lysine等氢键供体基团,可以在高级选项“Flexible H-bond donors in protein”中设置允许在对接实验中旋转
建立预测性QSAR模型引入新的特性
Flare V7对构建QSAR模型的功能上进行了扩展与增强,以便稳健地预测配体的活性和ADMET性质。
在新增的“一致性”回归和分类模型中,运行一致性回归模型(图5-左)可使Flare运行所有可用的机器学习回归模型(高斯过程、多层感知器、随机森林和支持向量机),化合物的活性预测值为每个单独模型预测的平均值。一致性分类(图5-右)将分子的分类预测为每个单独的机器学习分类模型(MLP、RF和SVM)中预测类别频次最高的那一个。
这创造了一个“一致性”的预测,使你能够用对化合物进行优先级排序,所有回归或分类模型都认为是好的配体更可能真的好,然后进行合成与测试。

图5. 一致性回归(左)和分类(右)模型使您能够对配体进行优先级排序,所有机器学习回归或分类模型都认为好的那些配体更可能真的好。
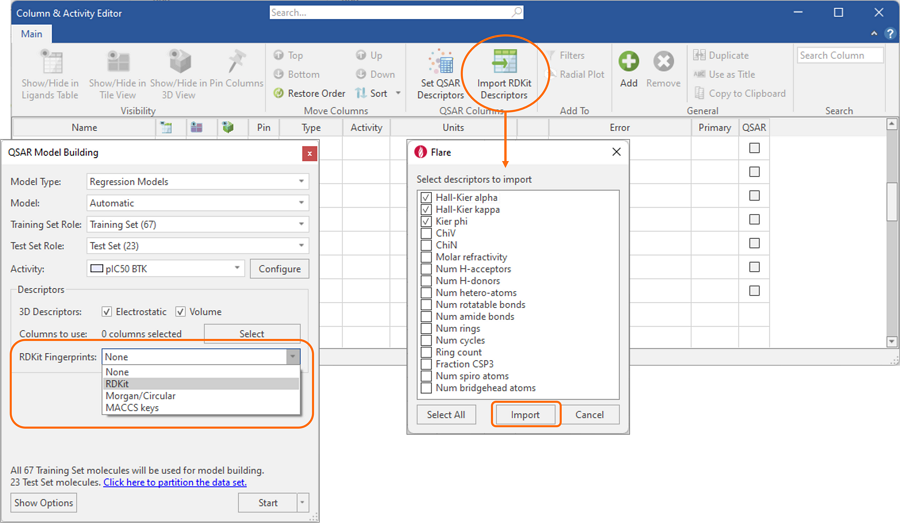
在Flare V7中,我们进一步简化了对RDKit物理化学描述符的使用,作为静电和形状的Cresset 3D描述符的替代,以便构建活性和ADMET性质预测的QSAR模型。
回归和分类模型都可以在选择的不同指纹上无缝运行,而几个广泛使用的物理化学描述符可以从Column&Activity Editor导入到配体表单中,见图6。
图6. RDKit指纹和描述符可以在Flare中用于构建活性和ADMET性质预测的QSAR模型。
最后,高斯过程回归模型现在可以计算每个预测值的标准偏差值(图7)。通常,当一个预测的标准偏差值远高于用于建立模型的训练集预测的标准偏差,则该预测的准确性较低,这让您能够在合成和测试化合物之前获得对Flare所做预测可靠性的置信度。

图7. Flare V7中的高斯过程模型计算每个预测的标准偏差值,使您能够在合成和测试化合物之前获得预测可靠性的置信度。
使用GCNCMC,让FEP与分子动力学模拟结果更加精确
直接与蛋白质结合的水分子通常与本体溶剂交换缓慢,使得一些系统在分子动力学模拟过程中平衡非常缓慢。在这种情况下,大正则方法,如大正则蒙特卡罗(Grand Canonical Monte Carlo,GCMC),可以允许通过模拟的水分子数量波动来加速平衡过程。这通过执行蒙特卡罗移动来实现,该移动将水分子插入到活性位点或从活性位点中删除,从而使得结合位点水与本体水之间的交换加速。
GCNCMC将传统的GCMC与非平衡候选蒙特卡罗(Nonequilibrium Candidate Monte Carlo,NCMC)结合起来成为大正则非平衡候选蒙特卡洛(Grand Canonical Nonequilibrium Candidate Monte Carlo,GCNCMC),其中水的插入和删除以渐进的非平衡方式进行,提高了对水采样的效率,并使得结合配体构象的采样增强。
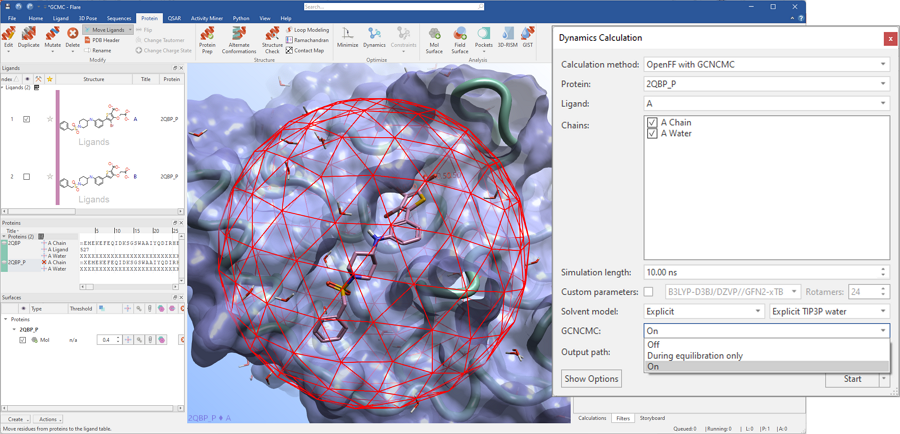
在Flare V7中,对于分子动力学模拟(MD)和自由能微扰(FEP)实验,使用GCNCMC可以更高效地对水采样。如图8所示,对于分子动力学模拟,可在整个模拟期间或仅在平衡阶段期间使用GCNCMC;对于FEP,可在平衡阶段期间使用GCNCMC。
图8. GCNCMC可用于分子动力学实验以改善模拟在平衡和生产阶段对水的采样和对结合配体构象的采样。
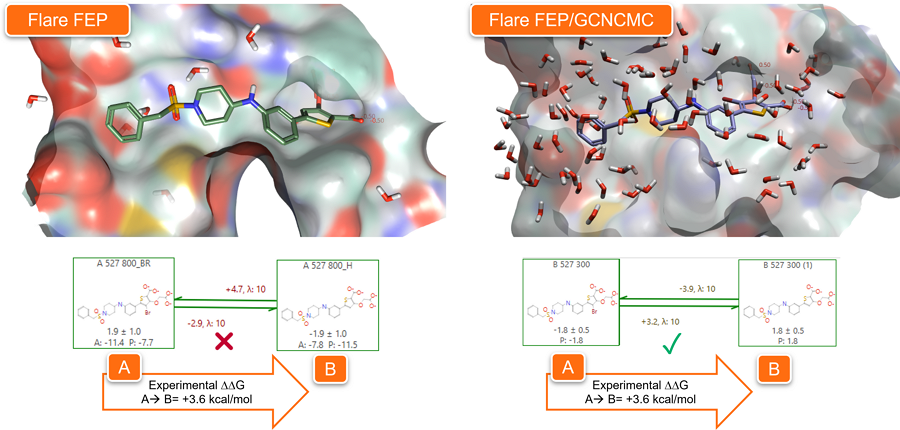
在Flare FEP计算的平衡阶段使用GCNCMC可以显著提高FEP方法的预测性能,特别是当蛋白-配体复合物结构的活性位点是一个封闭的口袋时,通常难以发生水合作用。
图9和图10所示的例子取自我们的验证实验。图9中的两个PTP1B抑制剂的区别仅在于噻吩环(橙色圆圈)上是否存在溴取代基,导致结合自由能ΔG的差值为3.6 kcal/mol。
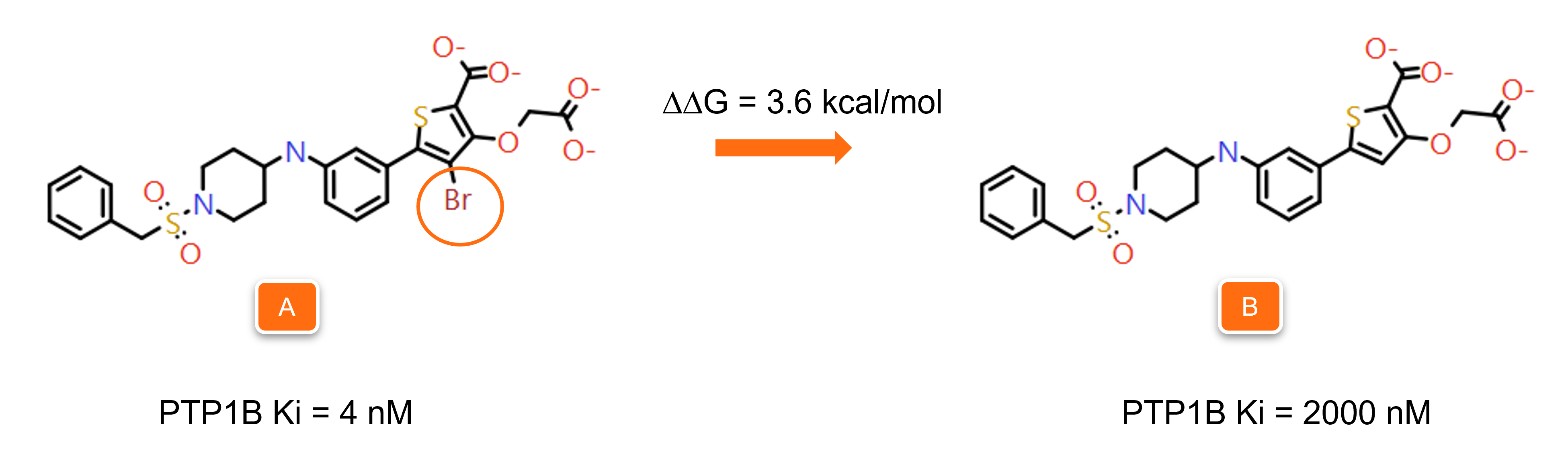
图9. 分子A和B仅在噻吩环相差一个溴,导致结合自由能ΔG的差值为3.6kcal/mol。
图10展示了在默认条件下(左)和使用GCNCMC(右)时在PDB 2QBP上进行Flare FEP计算的结果。在模拟的平衡阶段使用GCNCMC显著地改善了活性位点的水合作用,从而实现更准确的Flare FEP预测。
图10. 在Flare FEP计算将配体A(PDB:2QBP)转化为配体B的平衡阶段使用GCNCMC,可以显著改善活性位点的水合状态,并提高了FEP预测的准确性。
Flare更加友好
即将发布的Flare版本还包括一些新功能和改进,使得GUI更具吸引力,更易于使用。如图12所示,新增的两个关键特性是搜索Flare功能(图11)和“Pin Columns”功能。
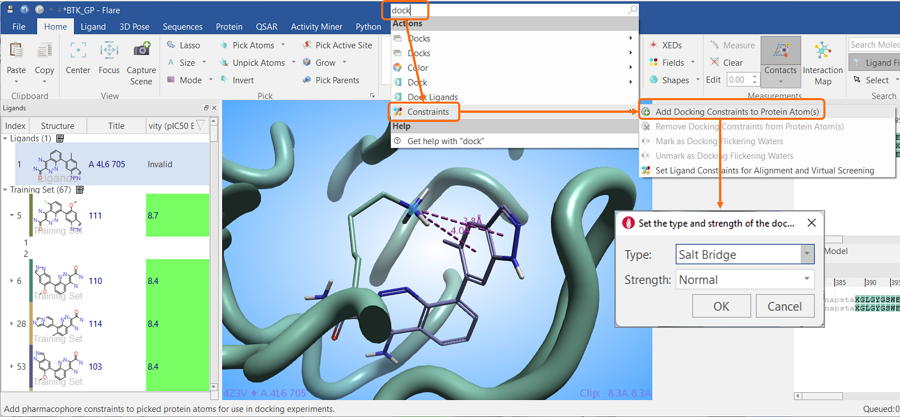
当您想快速找到Flare的按钮、菜单项或是可固定窗口时,这时Flare窗口顶部的“search”框就很有用了。例如,用户可能想设置蛋白质残基的对接限制,但不确定在哪里可以找到这个功能。在搜索框中键入“dock”将提供与搜索条件匹配的选项选择(图11)。从列表中,可以选择“Constrains”,然后选择“Add Docking Constraints to Protein Atom(s)”,这将自动打开所需的菜单。
图11. 用Flare窗口顶部的“search”框可以在Flare中快速找到所需的功能。
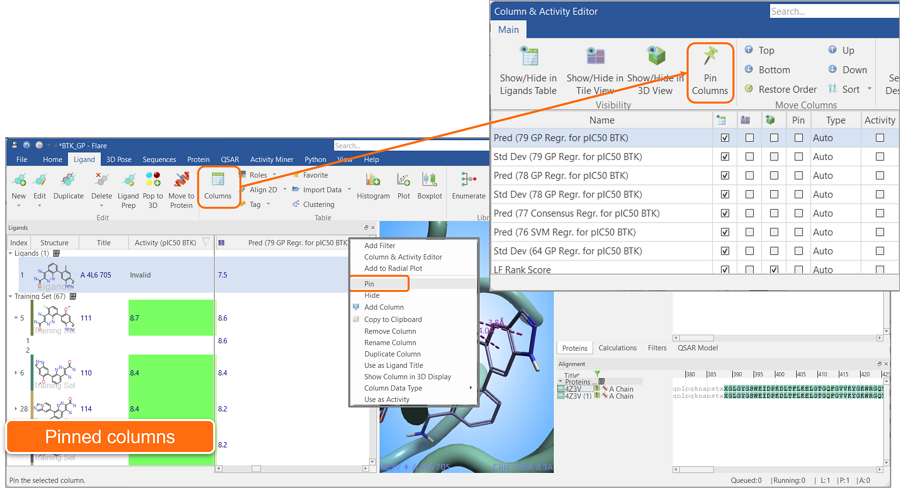
固定列可以使一个或多个列始终可见,或“固定”到配体表单的左侧。在下面显示的示例中,选择了“Structure”、“Title”和“Activity”列,以便在将配体表单向右滚动以浏览其他属性时始终可见。“Pin”功能可以方便地从大多数配体表单列的右键菜单和columns&Activity Editor中获得(图12)。
图12. “PIN”您最喜欢的列,以保持它们在配体表单的左侧始终可见。
敬请关注发布会
正如我们希望你会兴奋地看到的, Cresset基于配体和基于结构的分子建模平台Flare将在2023年春发布,它充满了新的科学、新的功能和可用性的改进。 不必等待很长时间,一旦更新完成,新版本就可使用,我们会尽快通知您。
敬请关注我们将于下个月发布的公告,以及计划于6月举行的激动人心的网络研讨会,我们将在会上更深入地展示和探索新功能。
参考文献
- Douglas P. Wilson, Zhao-Kui Wan, Wei-Xin Xu, Steven J. Kirincich, Bruce C. Follows, Diane Joseph-McCarthy, Kenneth Foreman, Alessandro Moretto, Junjun Wu, Min Zhu, Eva Binnun, Yan-Ling Zhang, May Tam, David V. Erbe, James Tobin, Xin Xu, Louis Leung, Adam Shilling, Steve Y. Tam, Tarek S. Mansour, and Jinbo Lee, Structure-Based Optimization of Protein Tyrosine Phosphatase 1B Inhibitors: From the Active Site to the Second Phosphotyrosine Binding Site, J. Med. Chem. 2007, 50, 19, 4681–4698. https://doi.org/10.1021/jm0702478