摘要:Activity Atlas1是Forge2 中一种新颖的定性分析方法,而 Forge2 是 Cresset 用于配体设计和 SAR 分析的强大工作平台。Activity Atlas 特别适用于将大型数据表压缩成单一图像,将构效关系数据汇总为高度直观的三维图,从而指导新化合物的设计与优化。在本案例研究中,Activity Atlas 用于分析从美国专利文献中获取的大规模 Orexin 2 受体配体数据集的结构-活性关系(SAR),其目的是快速研究并理解最近发表的骨架背后的受体活性的静电、疏水性和形状特征。
作者:Giovanna Tedesco. Cresset, Cambridgeshire, UK
编译:肖高铿
前言
每当启动一个新的研究项目或在团队之间转移项目时,必须尽快熟悉该项目的现有技术,以避免浪费资源去投资于过去已经探索过的方向。同样地,与当前项目相关的专利出版物可以为内部系列的优化决策提供信息。
历史信息,无论是内部的还是公开的,通常都以电子格式提供,然而,由于涉及的数据量庞大,探索针对某个靶标的已知构效关系(SAR)对于项目团队来说可能是一项繁琐且耗时的工作。
在本案例研究中,使用 Activity Atlas 中的活性悬崖总结方法来找到已公开的大规模 Orexin 2 受体配体数据集的关键 SAR 区域。目的是理解决定受体活性的静电、疏水和形状特征,并展示这种方法在大规模数据集的 SAR 分析中的适用性。
Suvorexant与人类Orexin 2受体的共晶结构
Orexin 体系由两种广泛表达的G蛋白偶联受体(GPCR)组成:Orexin 1 受体和 Orexin 2 受体(分别称为 Ox1R 和 OX2R),它们在中枢神经系统中响应两种肽类激动剂(orexin-A 和 orexin-B)以调节人类的睡眠和其他行为功能3。Suvorexant(一种对 Orexin 体系有强效治疗抑制作用的药物)与人类 OX2R 结合的共晶结构最近已被,分辨率为2.5Å。X-衍射结构(图1)揭示了 Suvorexant 如何在正构口袋深处以类似π-堆积的马蹄形构象结合到 OX2R 上,稳定了一组细胞外盐桥网络并阻止了激活所必需的跨膜螺旋运动。大部分配体接触涉及范德华力或芳香堆积。Suvorexant 的叔酰胺羰基与 Asn324 形成强氢键(图1),并且与 OX2R 结合位点只有少数其他直接的极性相互作用发生。几个水通过水桥介导了Suvorexant与极性氨基酸如 Asn324 和 His350 之间的氢键相互作用。
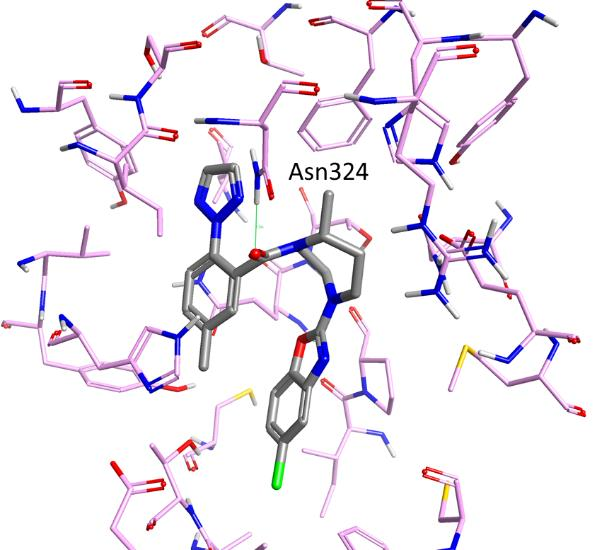
图1. Suvorexant与人类Orexin 2受体的共晶结构
数据集
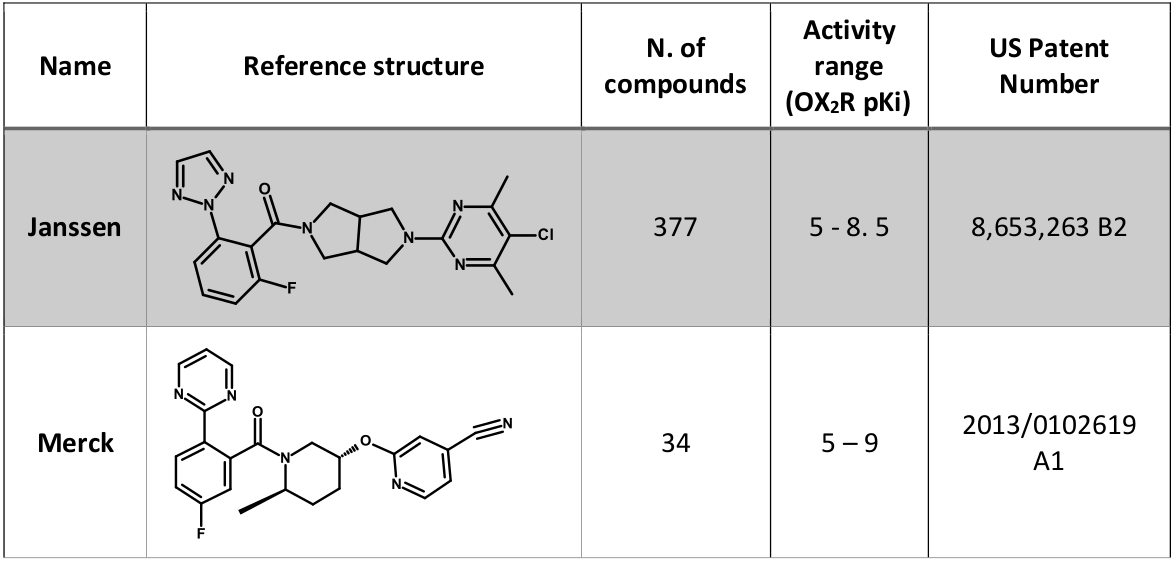
从 BindingDB6 下载了一个大约包含400个化合物的大数据集,这些化合物具有可用的 OX2R 活性数据(表示为nM或Ki),数据来源为“美国专利”。这些记录涵盖了 Janssen7 和 Merck8 在2013年至2014年间公开的专利信息。
该数据集由两个主要的化学系列组成:对于每个系列,选择活性最强的化合物作为该系列的参比分子(表1)。
化合物的构象搜索与叠合
在Forge中,通过基于场的叠合方式,首先将表1中的两个参比化合物叠合到Suvorexant的X-衍射共晶结构(PDB code:4S0V),此过程采用了“非常准确但缓慢(very accurate but slow)”的构象搜索:
- Max number of conformations: 1000
- RMS cut-off for duplicate conformers: 0.5
- Gradient cut-off for conformer minimization: 0.1 kcal/mol
- Energy window: 3 kcal/mol
然后,将数据集中的400个化合物通过最大共同子结构叠合方式叠合到相应的参比结构上,在此之前采用了“准确但缓慢(accurate but slow)”的设置来进行构象搜索:
- Max number of conformations: 200
- RMS cut-off for duplicate conformers: 0.5
- Gradient cut-off for conformer minimization: 0.1 kcal/mol
- Energy window: 3 kcal/mol
在叠合过程中,使用了“宽松”的最大共同子结构匹配规则,在这种规则下,子结构匹配忽略元素但考虑杂化状态,例如,环己烷可以匹配吗啉但不会匹配苯。在 Activity Atlas 中使用的3D相似性指标(如同在3D-QSAR中一样)需要将所有化合物叠合整齐,并且可能对叠合错误和叠合噪声敏感。
表1. 本案例的数据集及其参比分子结构
因此,建议对叠合情况进行目视检查,以确保没有异常存在,并且可以使用手动干预来改善次优的叠合。
因此,对某些化合物的叠合进行了手动调整,以提高整个数据集的一致性。
Activity Atlas模型
Activity Atlas 模型是按照概率方法计算的,该方法考虑了分子正确叠合的概率,而不是假定得分最高或选定的优选叠合就是正确的叠合。
这是通过为每个叠合赋予一个基于其相似性打分的权重来实现的。相似性打分高于某一阈值(该阈值可以由 Forge 自动计算,也可以由用户手动定义)的叠合被认为是完全可信的。相似性打分低于相似性阈值下限的叠合则不被信任并被舍弃。对于相似性打分值处于中间水平中的叠合,则应用线性缩放来赋予适当的权重。
同样地,也会根据每个分子的活性赋予一个权重。活性高于某一阈值(该阈值同样可以由 Forge 自动计算,也可以由用户手动定义)的分子被认为是完全活性的。活性低于活性阈值下限的分子则被认为是无活性的。对于具有中间活性水平的分子,则认为它们只有部分活性。
Activity Atlas 计算并以3D可视化形式展示以下内容:
- ‘Activity cliff summary’: 活性悬崖(Activity Cliffs)告诉我们关于构效关系(SAR, Structure-Activity Relationship)的哪些信息?
- ‘Average of actives’: 活性分子的共性是什么?
- ‘Regions explored’: 在此之前都进行了哪些研究工作?研究一个新的分子是否会提升我们对该领域的理解?
探索的区域分析还为每个分子计算了一个新颖性打分。
在本案例研究中,活性悬崖总结分析被应用于两个系列,目的是解释和理解它们的构效关系(SAR)。
结果
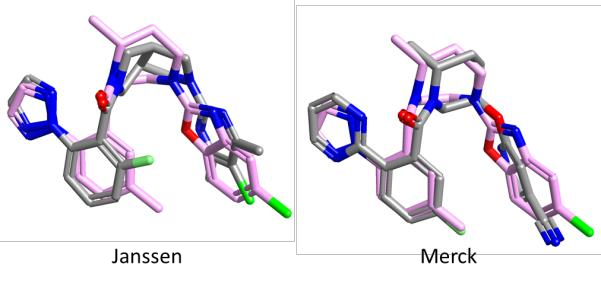
图2. 每个数据集的参比化合物(灰色)叠合到 OX2R 共晶结构(PDB code:4S0V)中Suvorexant的晶体结构(粉色)上。
图2显示了表1中的两个参比化合物(灰色)叠合到与 OX2R 共晶的 Suvorexant(粉色)的晶体结构上。Janssen 和 Merck 的化合物都与 Suvorexant 非常好地叠合,叔酰胺羰基指向 Asn324(这与 Suvorexant 中相应的羰基形成氢键相互作用)。这表明这两个化合物系列具有共同的结合模式。这一假设将通过 Activity Atlas 的活性悬崖总结分析进一步探索。
Janssen数据集的活性悬崖总结分析(Activity cliff summary analysis)
Janssen 数据集由377个化合物组成,OX2R活性pKi的跨度范围从5到8.5。
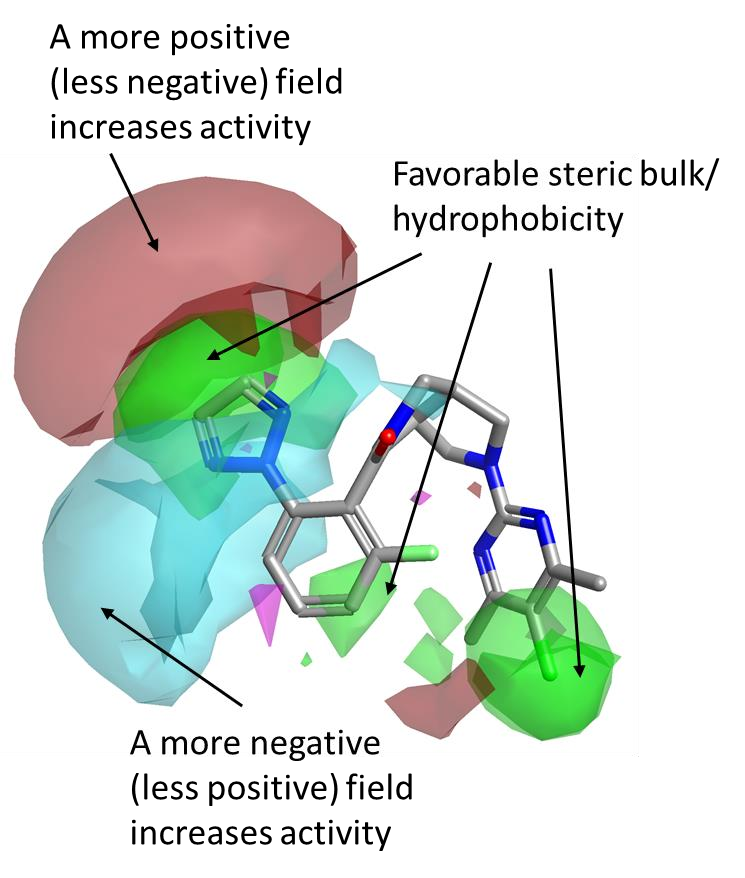
图3. Janssen 数据集的活性悬崖总结3D图,叠合到活性最强的化合物上(OX2R pKi=8.5)。
苯环左侧的SAR
对于这个数据集的活性悬崖总结分析表明,OX2R 活性会因为左侧苯环的邻位上有一个疏水取代基而增加,如图3中所示的有利(绿色)区域所指示。在这个环上的优选修饰特征在于邻位取代基边缘有更强的正(红色)静电场,以及在分子平面上方和下方包裹着间位和邻位取代基的更强的负(青色)静电场。
如图4所示,分子左侧周围的静电场存在显著差异,这与 OX2R pKi 的剧烈变化相关联。
因此,选择适当的杂环和电负性基团(如小体积卤素)来修饰左侧的苯环,这对于创建分子周围正确的正负静电场模式从而调节 OX2R 活性至关重要。
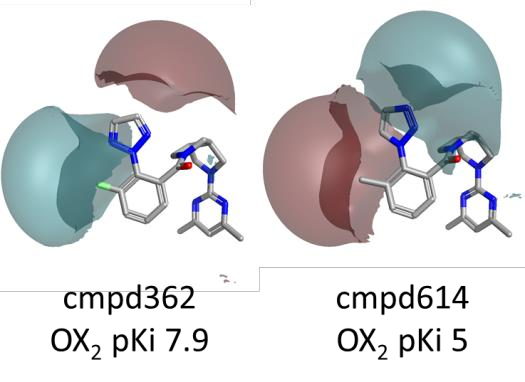
图4. 化合物362与化合物614的静电场差图。颜色编码:红色表示更正的静电场;青色表示更负的静电场。
芳香环右侧的SAR
如图3中的绿色区域所示,分子右侧嘧啶环的对位上的立体体积和疏水性对 OX2R 也是有利的。
在本例中,选择适当的修饰也可以对 pKi 产生显著影响,如下图5所示。
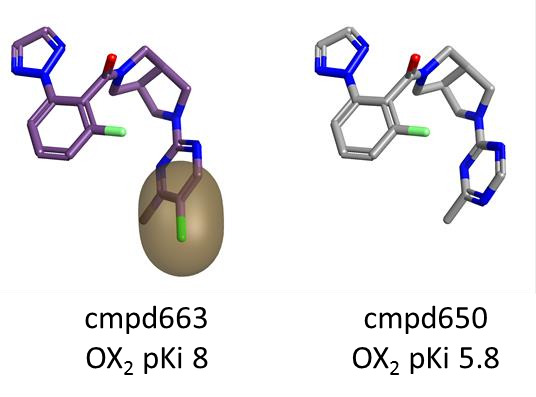
图5. 嘧啶环对位上的立体体积和疏水性(金色区域)有利于 OX2R 活性。
Merck数据集的活性悬崖总结分析(Activity cliff summary analysis)
这个数据集由34个化合物组成,涵盖了4个数量级的 OX2R 活性范围(pKi从5到9)。如图6所示的Merck数据集活性悬崖总结分析图与Janssen数据集分析图相当的不同。
这令人惊讶,因为Janssen和Merck的参比结构与Suvorexant都有非常好的契合(图2),这似乎表明这两个系列具有共同的结合模式。
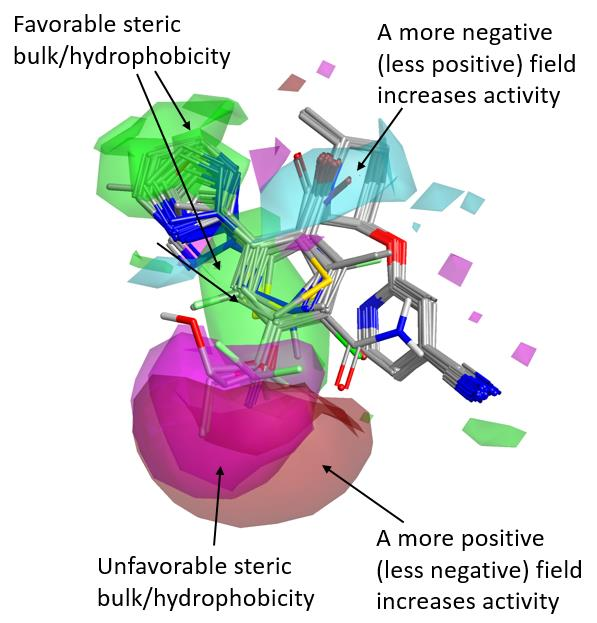
图6. Merck数据集的活性悬崖总结3D图
苯环左侧的SAR
关于苯环左侧的SAR,与Janssen数据集中邻位和间位取代基相关的有利的正、负静电场区域不再出现,尽管在这个位置上的立体体积/疏水性仍然有利(绿色区域)。相反,对位出现了强烈的信号。对位上的大体积取代基对OX2R活性不利(洋红色区域),而与更强的正静电场(或更弱的负静电场)相关的取代基,如图中红色所示,则有利于活性。
例如,如下面的图7所示,化合物397(对位-Cl)比化合物389的活性更强,后者携带一个体积较大的 OEt 基团,该基团进入了不利的(洋红色)形状区域。
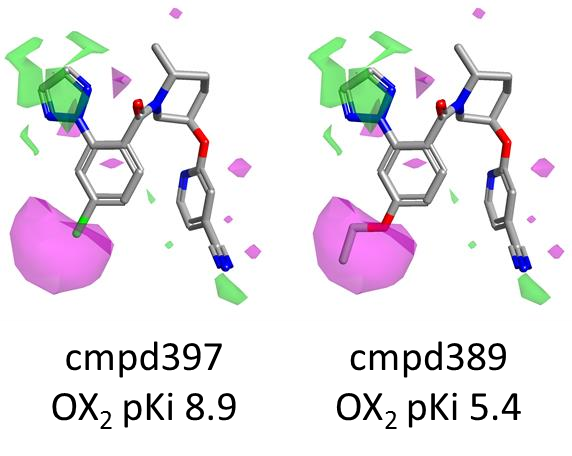
图7. 对位上的立体体积对 OX2R 活性不利。颜色编码:洋红色,活性不利的形状。
再次,化合物397(对位-Cl)比化合物387活性更强(图8),后者被一个-CN基修饰,该基团仅比Cl稍微大一些,但关联着更强的负静电场。
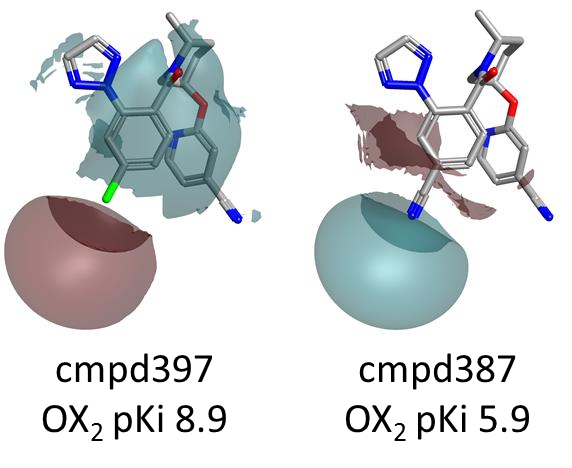
图8. 对位上的更强负静电场对 OX2R 活性不利。颜色编码:红色表示更正的静电场;青色表示更负的静电场。
然而,对 Merck 数据集的更深入分析显示,在苯环左侧的邻位上仅探索了三种不同的杂环取代基,即吡啶、三氮唑和噁二唑,其中后者仅在一个化合物中尝试过。从图9A中的静电场差图可以看出,吡啶和三氮唑产生了非常相似的静电场,不出所料,这与化合物具有相似的 OX2R pKi 值相关联。同样的取代基也在 Janssen 数据集中进行了探索,并且在那种情况下也没有导致活性的显著变化。相反,嘧啶和噁二唑则产生了略为不同的静电场(图9B),这在 Merck 系列的 OX2R pKi 中表现为更明显的变化。
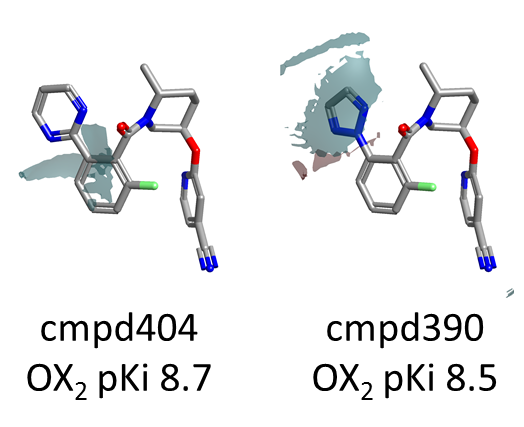
图9A. 化合物404与390的静电场差(Electrostatic field differences)
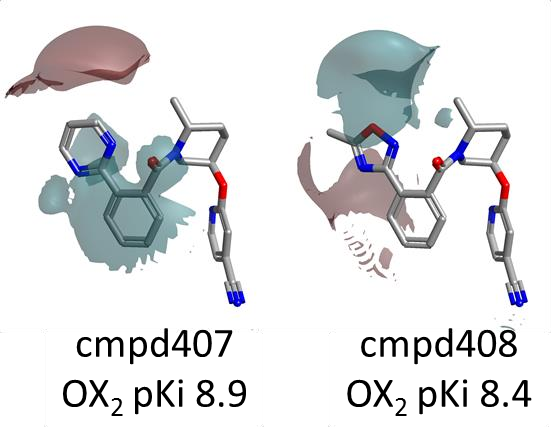
图9B. 化合物407与408的静电场差(Electrostatic field differences)。颜色编码:红色表示更正的静电场;青色表示更负的静电场。
有可能对于两个系列来说,正场区域对活性是有利的,但在 Merck 的 SAR 中,由于化学探索不足,这种效应未能显现出来。
吡啶右侧的SAR
回到图6中的活性悬崖总结图,右侧吡啶环的 SAR 缺乏变化是可以预期的,因为在这个数据集中该取代基没有发生变化(图6)。
叔酰胺羰基的SAR
与 Merck 化合物中的叔酰胺羰基相关的活性有利负静电场区域,与 Suvorexant 结合到 OX2R 时该羰基与 Asn324 形成氢键相互作用的事实是一致的。假设 Merck 化合物具有类似的结合模式,则分子左侧增强与 C=O 相关的负静电场的修饰应该对活性有利。
结论
Activity Atlas 是一种新的方法,可以将一系列化合物的 SAR 总结为可视化的3D模型,用于指导新分子的设计。在本案例研究中,Activity Atlas 证明是总结、分析和理解从美国专利信息中收集的大规模化合物集合的 SAR 的一个无价工具,能够快速提供极具价值的信息。
特别是,Activity Atlas 的活性悬崖总结以快速且高度可视化的方式突显了系列之间的共性以及 SAR 中的差异,这些差异可能与结合模式的细微变化有关。这两种信息对于决定项目的未来方向都非常重要:共性可能突出了迄今为止尚未开发的化学探索领域;而差异则提供了一种进一步优化感兴趣化学系列整体特性的方式。
文献
- https://cresset-group.com/software/activityatlas
- Forge现在已经整合到Flare. https://cresset-group.com/software/flare
- Li, J., Hu, Z. and de Lecea, L. (2014), Orexins integrate physiological functions. Br J Pharmacol, 171: 332-350. https://doi.org/10.1111/bph.12415
- Winrow, C.J. and Renger, J.J. (2014), Development of orexin receptor antagonists for insomnia. Br J Pharmacol, 171: 283-293. https://doi.org/10.1111/bph.12261
- Yin, J. et al. (2015) “Crystal structure of the human OX2 orexin receptor bound to the insomnia drug suvorexant,” Nature, 519(7542). Available at: https://doi.org/10.1038/nature14035.
- https://www.bindingdb.org
- US Patent 8,653,263 B2
- US Patent 2013/0102619 A1
联系我们
想在自己的项目中亲自使用Activity Atlas,请联系我们获取免费的试用版;或者联系我在线演示功能;你还可以采购软件或委托我们进行项目合作:info@molcalx.com。
原创文章,作者:小墨,如若转载,请注明出处:《将专利数据转化为SAR的3D图》http://blog.molcalx.com.cn/2025/01/11/converting-patent-data-into-3d-maps-of-sar.html



