摘要:我们展示了一个计算机辅助药物化学设计的练习:使用Activity Atlas1来评估和理解一组CDK2抑制剂的活性特征;使用Spark2提出新的探索思路;然后在由Activity Atlas生成的定性三维结构活性关系(3D SAR)模型的背景下,通过Forge3对这些新思路进行可视化评估。在这个练习中,回答了药物化学家在设计新的活性配体过程中三个核心问题:1)下一步要合成什么?2)为什么合成它?3)此前是否已经有人探索过该化学空间?
作者:Rae Lawrence. Cresset, Cambridgeshire, UK
编译:肖高铿
前言
药物化学家在设计新的活性配体的过程中所做的努力可以用回答三个看似简单的问题来概括:
- 下一步要合成什么?
- 为什么需要合成它?
- 此前是否已经有人探索过该化学空间?
这些问题通常是分别解决的。然而,在Forge和Spark的帮助下可以同时考虑这些问题,具有很大的价值。
在这个案例研究中,使用Cresset的基于配体的设计工具针对肿瘤学中广泛研究的靶标——细胞周期蛋白依赖性激酶2(CDK2)来解答上述问题。
方法
化合物库与叠合
从CHEMBL4收集了38个含有咪唑并吡啶结构的CDK2抑制剂,并进行了整理,以创建一个pIC50范围在4到9之间的分子数据集。
在评估活性与3D结构之间的任何关系之前,有必要对分子集进行叠合。在此案例中,我们选择将分子叠合到来自共晶结构1OIT中的配体(CHEMBL73303:pIC50 = 9.0)。由于数据集中的许多化合物含有一个该参比配体中不存在的溶剂暴露基团,因此我们另外识别了一个保持核心结构但扩展到1OIT配体末端磺酰胺之外的活性配体(CHEMBL70808:pIC50 = 8.52)。使用手动和自动方法将CHEMBL70808配体叠合到PDB 1OIT的共晶配体上,以确保深嵌入结合位点的咪唑并[1,2-a]吡啶基团的良好对应。进一步用手动叠合来确保磺酰胺基团,尽管是溶剂暴露的,但仍具有可比较的取向。这一对配体(图1)用作且权重相等的参比分子,随后将所收集的38个化合物后叠合到这对参比分子上。
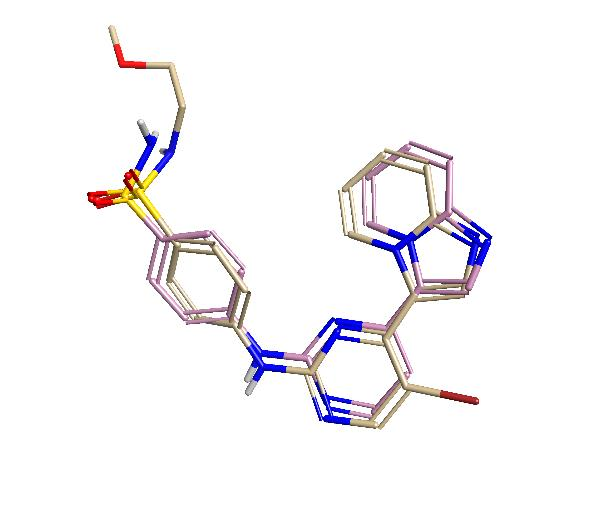
图1. PDB 1OIT的配体(粉色)和CHEMBL70808(灰色)的叠合。
在Forge中,将CDK2抑制剂的数据集叠合到两个等权重的参比分子上,使用50%场和50%形状以及软排除体积来生成叠合(图2)和相似性分值(范围从0.59到0.85)。由于叠合是每个3D-QSAR方法的核心,因此对这些叠合结果进行了视觉检查并手动微调,以确保所有侧链具有一致的取向。
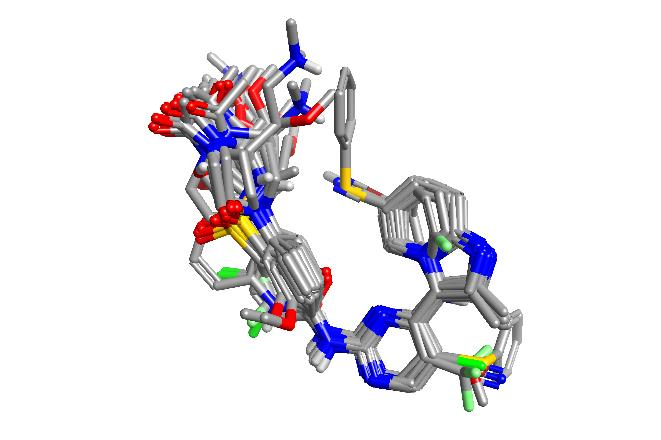
图2. 38个CDK2抑制剂叠合到 PDB 1OIT的共晶配体以及CHEMBL70808上
用Activity Atlas进行3D-SAR建模
为了生成对驱动活性的特征进行定性评估,进行了Activity Atlas模型计算。
Activity Atlas 是 Forge 中的一项功能,它根据叠合好的分子生成直观醒目的3D图。这些模型展示了:活性化合物的平均静电和形状;静电、形状和疏水性中活性悬崖的总结;以及已探索的区域。由 Activity Atlas 生成的模型旨在帮助回答前面提出的问题,并在图3至图5中展示。
在图3中,展示了平均活性分子图。它指出了数据集中活性分子的共同静电和疏水性特征——基本上,不具备这些特征的分子不太可能具有任何显著的活性。在所有活性分子中都存在中央氢键供体(胺)/氢键受体(嘧啶)模式,该模式反映了与CDK2铰链区域的相互作用。靠近磺酰胺和咪唑并吡啶氢键受体的负电荷区域也在所有活性分子上出现。
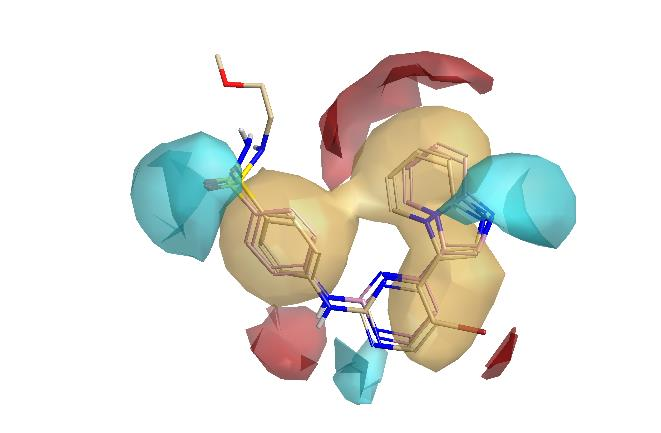
图3. 活性分子的平均静电场和疏水场Activity Atlas图。蓝色 = 负静电场;红色 = 正静电场;金色 = 疏水性。
图4展示了静电和立体空间中活性悬崖的总结——即活性分子平均图的细节。蓝色区域表明,使该区域静电更负(或减少正电静电性)可能会增强活性;红色区域表明,使该区域静电更正(或减少负电性)可以提高活性;最后,绿色区域表示立体位阻是有活性利的,而粉色区域则表示不能容忍立体位阻。
图4底部以更适合检查咪唑并吡啶的角度展示了活性悬崖分析。Activity Atlas模型侧倾显示,更正或较少负静电的π云应该能够增强活性,并且指出靠近氢键接受环氮的位置有更强的负电性也有利于提高活性。
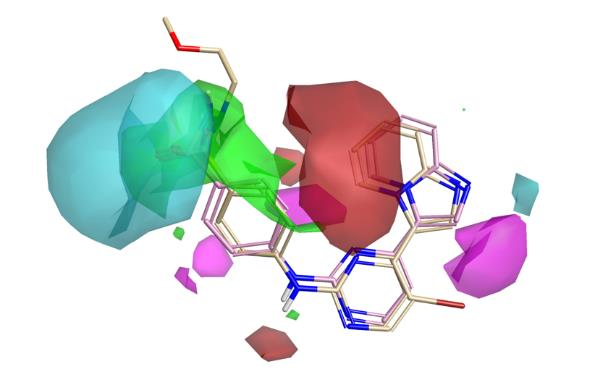
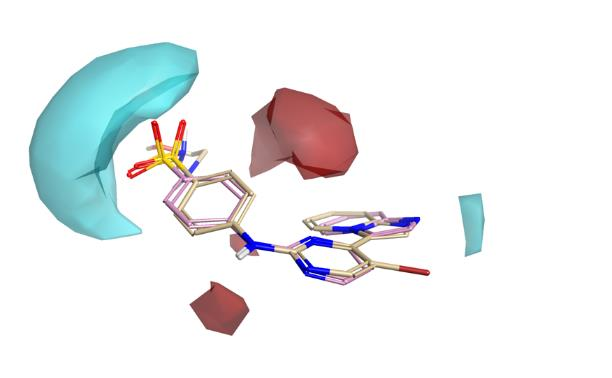
图4. 静电和立体活性悬崖总结的两个视角。上图:静电和立体效应。下图:仅显示静电效应,视图绕X轴旋转。蓝色区域表明负静电特性是活性有利的;红色区域表明正静电特性是活性有利的。绿色区域在立体效应上是有利的,而粉色区域对立体位阻基团是不利的。
对所探索的静电区域的评估表明,至少在38个分子中有10个分子具有如图5所示的贡献。这意味着未被探索的区域可能为修饰和进一步优化提供了机会。
探索区域的分析还对所有数据集化合物以及新设计分子进行了新颖性计算。所计算的新颖性可以作为指示,显示如果合成该分子将能获得多少新的信息。
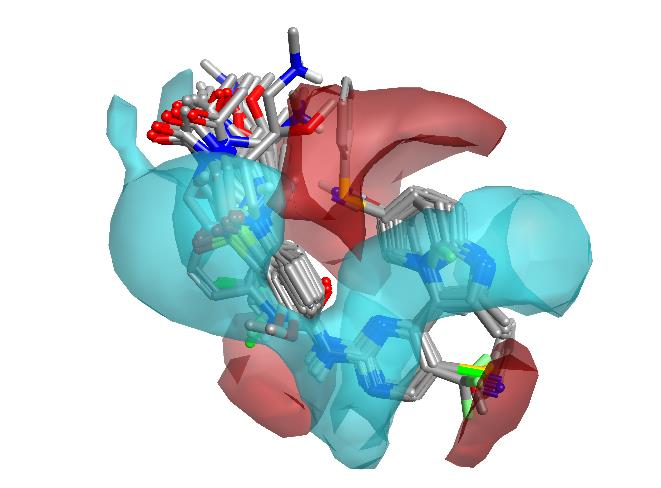
图5. 叠合的配体及其探索过的静电空间区域显示
用Spark生成新的想法
在手头有了结构-活性关系(SAR)分析之后,使用Spark来寻找图6中所示的1OIT配体中标记部分的生物电子等排体替换。这些片段来源于由eMolecules衍生的硼酸试剂数据库。
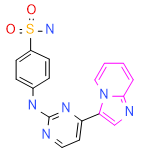
图6. 指定使用Spark的eMolecules硼酸试剂数据库来识别PDB 1OIT配体中以粉色显示部分的生物电子等排体替换。
结果与分析
从Spark实验中挑选了四个结果进行进一步分析,如图7所示。每个选定的Spark苗头化合物要么是为了增强活性,要么是为了挑战模型,因为该模型是基于相对较少数量的化合物构建的。
每个提议的生物电子等排替换都来源于可在2天到4周内由供应商发货的市售试剂。
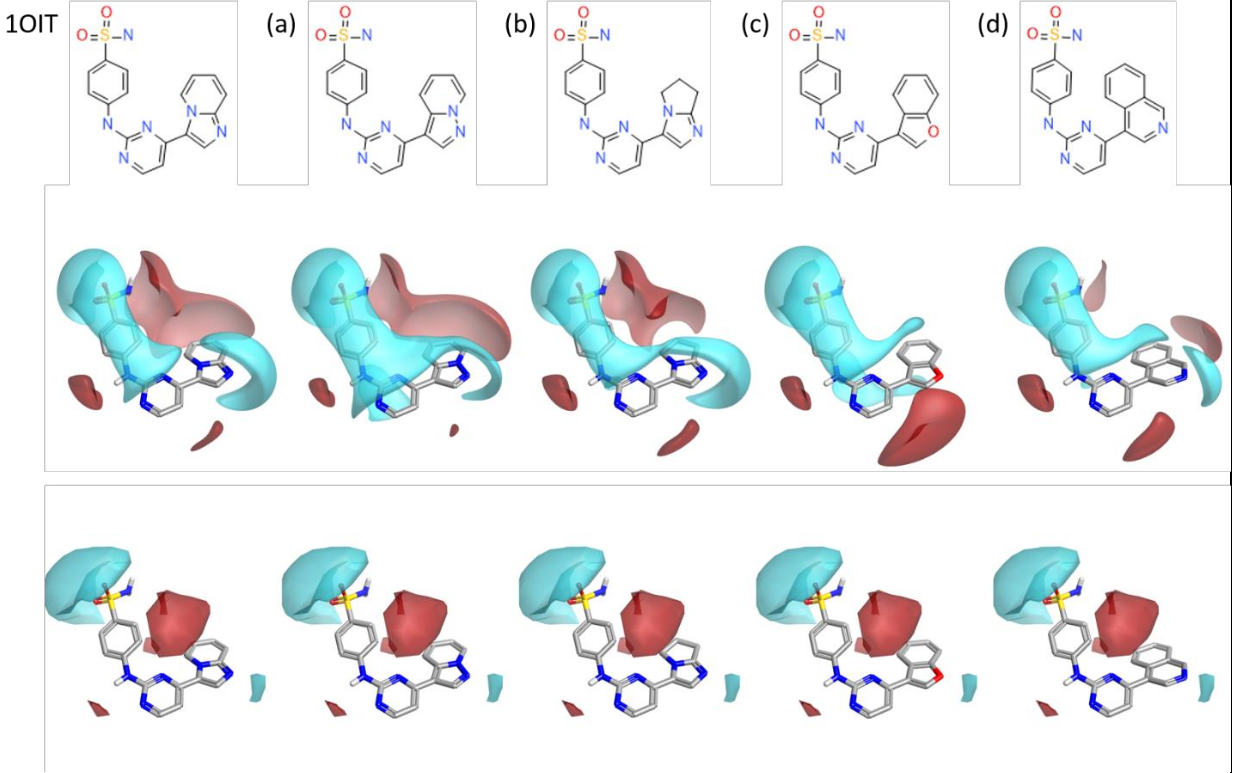
图7. 来自1OIT的起始配体和一些精选的Spark结果(a-d)。上图:2D视图。中图:3D视图,显示正负相互作用势。下图:在Activity Atlas静电活性悬崖总结的背景下的展示。
在(a)中,吡唑并吡啶替换将测试氢键受体强度对于原始咪唑并吡啶的重要性。将杂原子移到环的另一侧会导致氢键受体强度减弱,同时保持环上方合理的电子密度。请注意,这种替换会导致中央嘧啶环的电子更加丰富。
二氢吡咯并咪唑(b)具有与起始配体相似的静电特性,但通过饱和此环来测试对于缺电子芳香环的需求,从而移除此区域的所有π电子。
在(c)中,苯并呋喃可能适合用于测试模型,因为它完全移除了强氢键受体,取而代之的是一个较弱的(氢键受体)特征。虽然这可能对活性没有促进作用,但该分子会为模型增加知识,并且这种试剂可以立即获得。
最后,在(d)中,建议用喹啉替换咪唑并吡啶。从5,6元环到6,6元环的变化为氢键受体引入了不同的几何结构,但在可以立即发货的试剂中保持了起始配体的许多静电特性。如果这种取代是可以接受的,那么Spark的结果中还包含其他更为独特的建议,其中包括在这个位置上的6元环中的氢键受体。
结论
本文介绍了我们针对药物化学设计三个核心问题的回答:
1. 下一步该合成什么?
每位化学家都有一套从其实验室经验中积累起来的技巧和替换方法。Spark以无偏见的方式增强创意(Idea)的生成,结合化学家的直觉,可以提供关于在潜在的开放知识产权空间中可以去合成哪些化合物的想法,同时仍然保留了活性分子的特性。通过使用eMolecules试剂数据库,Spark实验的还提供了适用于特定化学反应的试剂和订购信息,以提高实验室效率。
2. 为什么要合成它?
将Spark和化学家设计的想法放在Activity Atlas模型的背景下进行考察,是一种确保新化合物符合活性分子特征的方法,或者相反,是为了测试模型的特定方面而设计的。平均活性分子与活性悬崖总结图的结合可以提供所需的逻辑依据,以确信将新设计带到实验室是值得付出努力的。
3. 之前是否已经探索过该化学空间?
在Activity Atlas中,探索区域分析结合新颖性计算可以用来评估Spark和化学家设计的想法是否位于已经探索过的化学空间内,或者它们是否对映于迄今为止尚未探索的空间区域。
参考文献
- https://cresset-group.com/software/activityatlas
- https://cresset-group.com/software/spark
- Forge停止供应,其全部功能现在可在Flare获得. http://www.cresset-group.com/software/flare
- P. Bento, A. Gaulton, A. Hersey, L.J. Bellis, J. Chambers, M. Davies, F.A. Krüger, Y. Light, L. Mak, S. McGlinchey, M. Nowotka, G. Papadatos, R. Santos and J.P. Overington (2014) ‘The ChEMBL bioactivity database: an update.’ Nucleic Acids Res., 42 1083-1090.
联系我们
想在自己的项目中亲自使用Activity Atlas与Spark来设计新化合物,请联系我们获取免费的Flare试用版;或者联系我在线演示功能;你还可以采购软件或委托我们进行项目合作:info@molcalx.com。
原创文章,作者:小墨,如若转载,请注明出处:《药物化学设计的核心问题——Forge和Spark之间的协同关系》http://blog.molcalx.com.cn/2025/01/11/at-the-heart-of-medicinal-chemistry-design.html



