摘要:FieldTemplater是药物设计软件Forge里生成场药效团模型的模块,它以几个活性化合物为输入条件产生药效团模型(Template)、预测化合物的生物活性构象。本文介绍了FieldTemplater的计算原理,操作步骤,影响因素,结果分析,结果的挑选以及应用案例。
一.前言
分子叠合(比较)、基于配体的虚拟筛选与设计等都需要用到参比分子(Reference)或模板分子(template)。比如用Forge进行大数据集的分子叠合(虚拟筛选)、3D-QSAR分析,Blaze或ROCS进行虚拟筛选都需要用参比分子。在分子叠合、虚拟筛选或3D-QSAR分析时,参比分子或模板分子的构象首选其与靶标结合的生物活性构象。生物活性构象常常从配体-靶标的复合物晶体结构提取而来,但是很多靶标还缺乏这种复合物晶体结构,因此需要用预测的方式来获得可能的生物活性构象。
FieldTemplater是Forge里的一个功能模块,它用静电场、疏水场来比较分子以发现公共模式。针对几个结构完全不同但与同一靶标结合的化合物,FieldTemplater可以在没有蛋白信息的情况下搜寻它们的生物活性构象与相对叠合方式。其它药效团软件通常采用氢键供体、受体、疏水中心等类似概念建立模型,而FieldTemplater采用静电、分子形状与疏水场来建立模型(图1)。
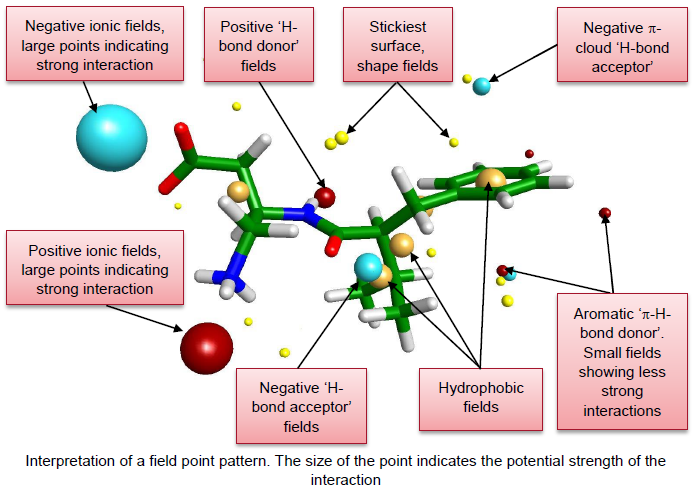
图1. 场点(Filed Point)
FieldTemplater药效团识别计算的假设是:两个分子以相似的结合模式(相互作用方式)结合到蛋白的同一个结合位点,因此化合物应该有高度相似的场点模式。FieldTemplater因此遍历一组配体的构象空间、并识别其公共场模式。多个结构多样化合物的场模式很可能就解释了这些化合物与靶标的结合模式。分子叠合的早期阶段采用场点来评估共性,然后再用全场来进行优化。一旦药效团模型生成,每个模型就给每个分子生成一个活性构象,模型就代表了这些活性构象之间的关系。每个药效团模型就是一个“模板”(Template),每个模板里含有一个个的分子。在本文中,药效团与模板是同一个概念,只是FieldTemplater的药效团元素是场点(Field Point)而传统的氢键受体、供体等。
FieldTemplater将两个或多个活性分子做为输入:可以是2D结构或单构象的3D结构,也可以是预先生成多个构象的3D结构。它能够用最多10个活性分子产生模板,但最佳的还是用3-5个分子生成模板。对复合物晶体结构的测试表明,FieldTemplater可以高效的重现许多配体的结合构象。
模板的生成过程如下图2所示:
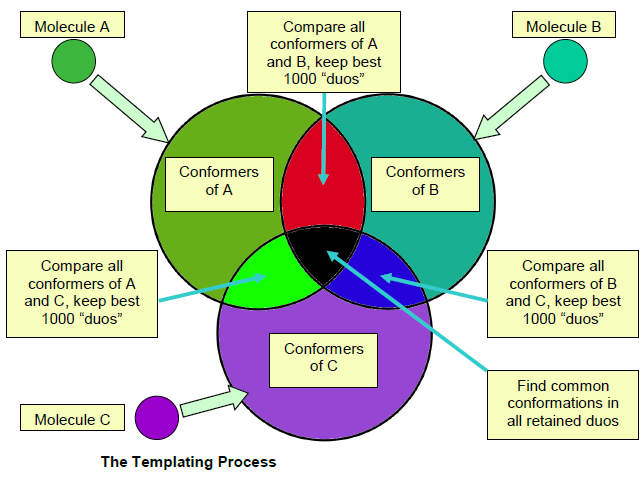
图2. FiledTemplater生成模板的过程
二. 如何选择分子建立FieldTemplater模型
选择什么样的分子建立药效团模型对FiedlTemplater至关重要,决定了结果的成败,因此分子的选择是FieldTemplater成功计算的关键。当选择分子时,需要考虑很多的因素。
1. 总则
FieldTemplater假设:全部的分子以相似的结合模式结合到同一个靶标上。因此,需要选择那些可能满足这个假设的分子。尤其是,如果有证据表明两个活性化合物有完全不同的结合模式或结合在别构位点,那么就不应该将这的两个分子用于FieldTemplater建立模型。此外,还假设分子有相似的大小,因此尺寸差异小的3个分子要比尺寸截然不同的3个分子建立的模型要好。
2. 分子柔性
分子越柔性, 分子可采取的形状越多,也就越难以发现其“正确”的构象。如果一个化合物的柔性键数量在8个以上,就不太可能用构象搜索找到生物活性构象,因此FieldTemplater也就不能够找到合理的解(模板)。因此,如果分子含有不影响活性的柔性侧链的话,那么可以将该柔性侧链用一个构象刚性的结构替换,比如柔性的正丁基可以用环丁烷基替换,或者将该侧链删除后再用FieldTemplater建立模型。注意:现有的知识是非常有用的。如果你知道或猜到了分子某个部分的构象,那么就可以用这些信息对分子进行约束的构象搜索。
3. 活性
第三个标准是活性。分子与活性位点结合越强,则其含有活性位点的信息越多,越有可能得到有意义的信息。然而,在活性与分子尺寸之间取舍是一个权衡利弊的过程:假定一个分子尺寸大且柔性,活性为1nM;而另一个分子尺寸小,活性为10nM, 显而易见地第二个分子通常是建立模型更优的选择。如果可能的话,可以裁掉对活性贡献有限的官能团或侧链:尤其是那些出于非活性的原因(比如改善溶解度、DMPK性质)而引入的大基团。假定两个分子的活性差不多,优先选择极性基团少的化合物。通常,最佳地选择策略是相似大小的分子选择配体效率(ligand efficiency,LE)高的那个。
4. 多样性
第四个标准是结构多样性。FieldTemplater依赖于不同输入分子的不同构象空间以便消除构象自由度、并最终识别出生物活性构象。如果输入分子的构象空间相似,那么会产生多个解(叠合)而没有办法识别哪个是活性构象。尤其当几个输入分子是同系物时,第1个分子的构象空间都可以被第2个分子匹配,那么第2个分子因此不能提供更多的信息以决策哪个构象更可能是活性构象。
值得注意的是:FieldTemplater所述的多样性与药物化学同系物概念可能不一致。比如,将分子的母核通过原子替换(比如吲哚变为苯并咪唑)在药物化学上被认为得到新系列化合物而被视为具有多样性;但是这些化合物在同样的位置具有同样的取代基,因此FieldTemplater在进行比较时认为此类变化并没有带来更多的形状信息、也就认为此类新系列化合物没有带来多样性(或更多的信息)。相反,药物化学认为增加或减少链的长度(比如将丙基裁剪为乙基链接臂,将尿变为酰胺)是一种“同系物”工作,但是在FieldTemplater里此类变化却能代来更多有价值的信息。
活性化合物的公共两面角是一个常见问题(图3)。在分子叠合的时候,如果所有分子有一个旋转键叠合在一起,有可能出现这样的情况:无论第一个分子这个可旋转键采取何种角度,其它的分子都可采取一模一样的两面角度进行叠合。此时可旋转键的定义不全问题出现。警示信息之一是生成非常多非常多的模板(Template,即药效团模型):此时你需要去仔细检查模型,是否出现可旋转键定义不全问题(公共两面角问题)。因为不同的两面角即产生不同的模型,但是却带来不了更多的信息(也不能区分哪个模型更重要,仅是两面角有差异而已)。如果你在建立药效团模型时(进行3D-QSAR研究时也是一样的)出现公共两面角问题,应该记住此时两面角定义不全,对此类模型应保持警惕之心。或者通过引入一个不具有该两面角的分子来破解之,比如引入链加长或变短的化合物。
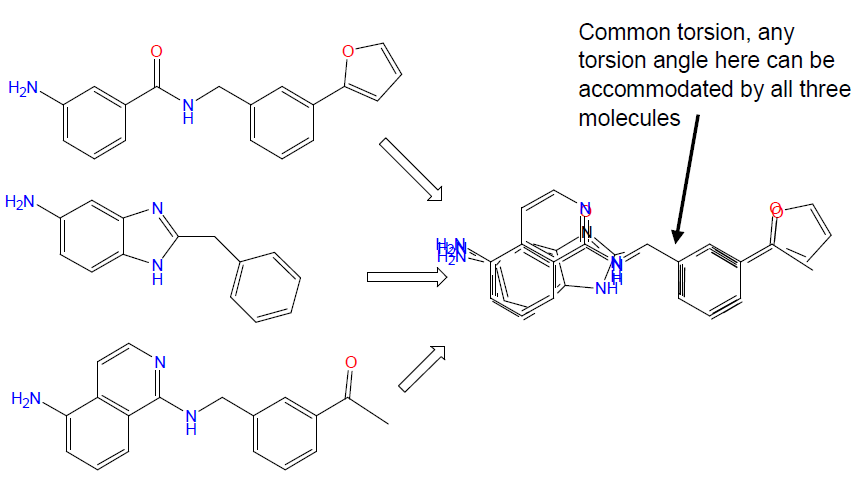
图3. 公共两面角问题:这三个分子具有相似的两面角,它们叠合在一起,可能建立非常多的药效团,其区别仅在于两面角不同。破解之法是引入链长不同的化合物或不具该两面角的化合物。
5. 分子的数量与尺寸
FieldTemplater最好使用3-5个分子来建立模型。两个分子会产生太多的叠合,结果是“正确”的模型与“错误”模型一起出现而分不清。如果用5个以上的分子建立模型,计算变的非常、非常慢而不可接受,而且获得满足全部化合物的模型概率变的很低。在FieldTemplater里,最多可以用10个分子建立模型。
用相似尺寸的分子建立模型是最佳的,因为FieldTemplater假设所有的分子结合于同一位点、它们的构象占据大致相似的空间(体积)。如果一个分子显著地比其它分子大,那么比其它分子大的那部分区域与其它分子没有任何的重合、也产生不了任何的有用信息。这种情况下,构象噪音使得发现有用的模型变地更加困难。
6. 不确定结构的处理:消旋体,质子化状态与互补异构体
当化学结构因为消旋体或互变异构体而不确定时,可以将多种可能的结构以“Isomers”方式作为输入存为一个结构文件。可以用拖放的方式将保存的文件载入到FieldTemplater, FiledTemplater会识别Isomers。另一种将分子读入FiledTemplater的方法是通过File菜单的Add molecules选项“multiple isomer”读入文件。Isomers在构象搜索时作为不同的分子处理,但是在生成药效团(模板)时被视为一个分子。FieldTemplater会自动地选择isomer生成模板并展示结果。应当要注意:由于isomer被视为一个分子,如果一个分子最多使用了200个构象,那么一个分子的8个isomers中的任意一个isomer都有200个构象参与计算,这使得计算变得非常、非常慢,需要计算非常长的时间。
二. FiledTemplater操作流程
1 打开FieldTemplater
(1) 通过新建项目从零开始
通过Forge菜单:File>New Project的方式从项目导航(New Project Wizard)里选择”Create a Pharmacophore with FieldTemplater’,见图4。
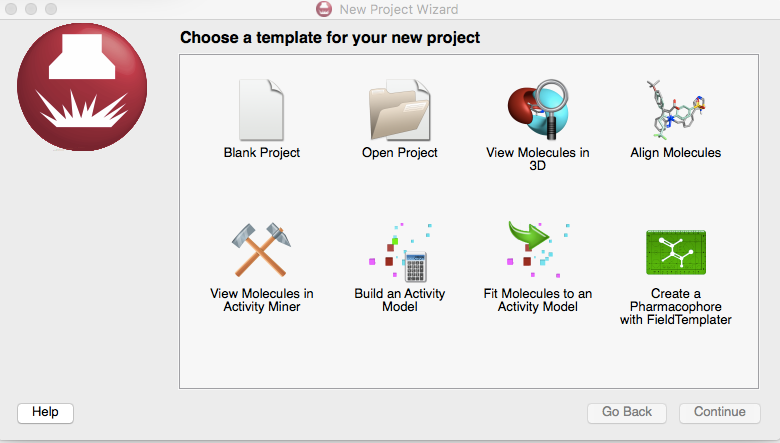
图4. 新建一个FieldTemplater项目: 点击右下角的Create a Pharmacophore with FieldTemplater
(2) 已经导入分子
在Forge的分子表单里选择用来建立药效团模型的分子,右键单击,出现Run菜单,选择“Run FieldTemplater on Selected Molecules”, 见图5。
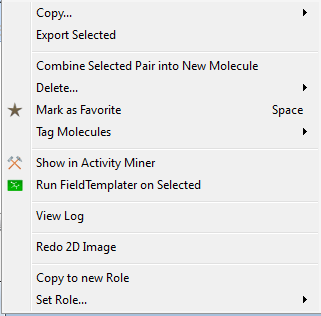
图5. Run FieldTemplater on Selected Molecules
2. FieldTemplater参数设定与计算
打开FieldTemplater后,弹出FieldTemplater processing对话框,见图6.
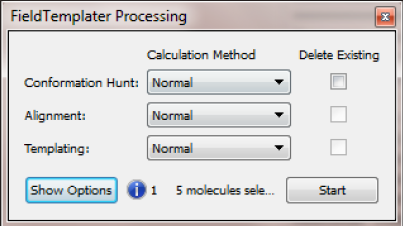
图6. FieldTemplater processing对话框
图6的FieldTemplater processing对话框可以控制构象搜索、分子叠合与模板生成参数与选项:
- Quick(fast but some templates may be missed)
- Normal (recommended for normal use)
- Normal (large mols) (more conformations are generated: suitable for molecules with >6 rotatable bonds)
设定好选项后,点击Start按钮开始FiledTemplater计算。
3. 结果分析
计算完毕,Forge的界面类似图7:
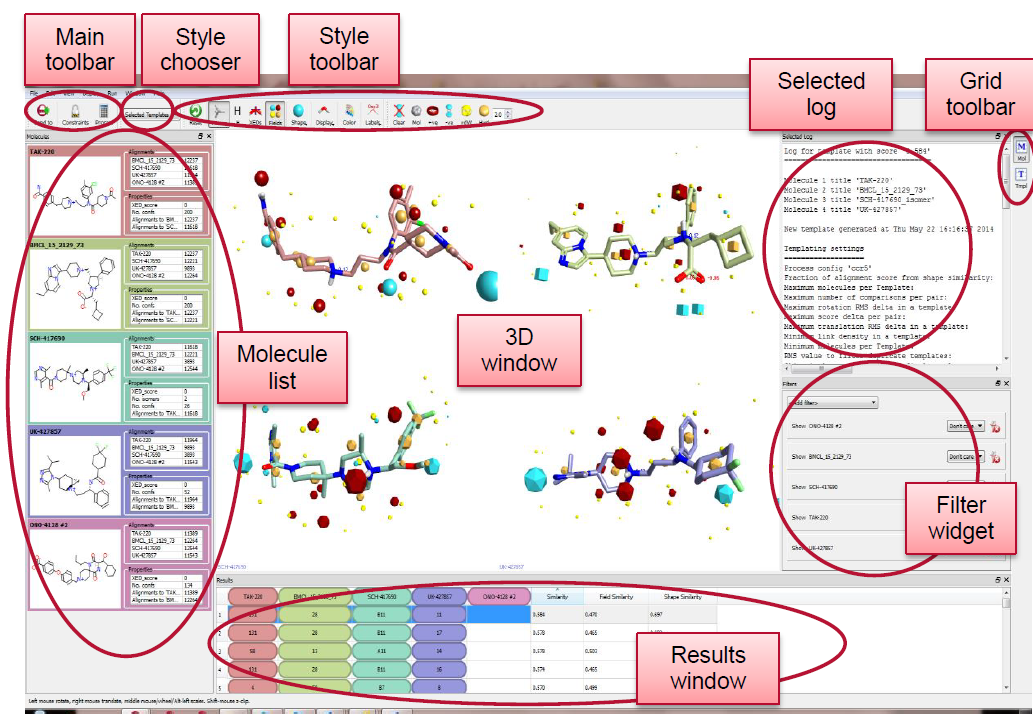
图7. FieldTemplater结果视窗。 Molecule list:控制在3D视窗中展示哪些化合物;Result Windows控制在3D视窗中展示哪个template;GRID toolbar控制分子的展示方式:分开还是叠合展示。
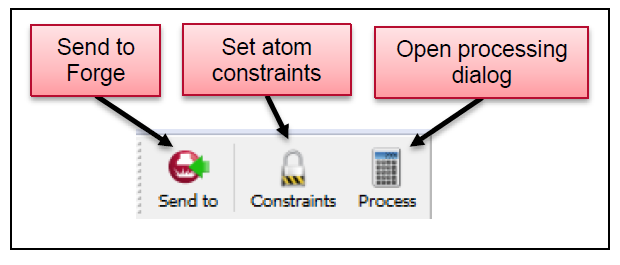
图8. FieldTemplater的主工具栏可以用来将结果发送给Forge做为模板,或者进一步计算
图9. FieldTemplater Grid工具栏:可以控制分子与template在3D视窗中的展示方式(叠合或分开)

图10. FieldTemplater结果视窗:包含所有可能的模板,以及每个化合物与模板之间的相似性、形状与静电打分值。
4. 结果的选择
不幸的是,打分最高的模板并不总是对的。然而,大部分情况下,正确的答案总是靠近打分最高几个模板里。模板的打分衡量了模板里分子之间的场、形状相似性程度。打分高的模板里的分子之间比起那些打分低的模板的分子之间具有更高的场与形状相似性。要注意的是,模板的打分的绝对值并不是孤立的信息,极性越大、尺寸越大的分子倾向于打分偏低:3个脂肪性分子如果打分0.75,但是3个更大的、极性更强的分子生成模板的打分可能只有0.5。这并不意味着前者比后者有更高的概率是对的。具有不同分子的模板的打分值是不具备可比性的,因此,模板打分值仅适用于含有同样分子的模板间进行比较。比如,如果你用A,B,C,D四个分子生成模板,那么含有ABCD的模板会先出现,然后是全部的ABC模板、ABD模板扥等等。ABC、ABD等模板总是排在ABCD模板之后。
三.接下来可以做什么
- 将模板用于Forge 3D-QSAR的参比分子或用于分子叠合
- 将模板用于SPAKR的起始分子
- 将模板用于BLAZE虚拟筛选
- 收集很多的模板用于靶标预测、新适应症开发
四. 应用案例
基于场的虚拟筛选与生物等排体替换发现和优化新型小分子HIV-1进入抑制剂:http://blog.molcalx.com.cn/2017/02/28/field-technology-bmcl2014-marina.html
五.联系我们,软件试用
试用下载:http://www.cresset-group.com/try-a-free-demo
试用人中文信息提交:



