摘要:手性的量子力学计算已迅速成为归属有机化合物(包括天然产物)绝对构型(absolute configuration, AC)的最流行方法。现在非专业人员很容易以黑盒模式使用含时密度泛函理论(TDDFT)计算电子圆二色性 (ECD)光谱。然而,不加批判的态度很容易给出错误的答案。本文介绍了在进行TDDFT计算ECD图谱时良好计算规范的讨论,通过最近文献中的几个例子来说明几个最重要的关键点。
编译:肖高铿
原文:Pescitelli G, Bruhn T. Good Computational Practice in the Assignment of Absolute Configurations by TDDFT Calculations of ECD Spectra. Chirality. 2016;28(6):466-474. doi:10.1002/chir.22600
前言
计算能力的迅速发展[1],彻底改变了化学家和其他科学家归属/指认新分子绝对构型(AC)的基本方式[2]。此前完全依靠Bijvoet方法或化学关联法,随着手性光谱学的出现,尤其是电子圆二色性谱(electronic circular dichroism, ECD)的出现,最近这个问题已成为光谱学的主要目的。然而,长期以来,新化合物ECD光谱的解释完全基于经验或半经验方法,例如光谱比较或扇区规则。因此,毫不奇怪,诸如激子手性之类的非经验分析方法能够迅速流行并激发了许多研究。然而,只有当手性光学性质的从头计算理论模拟,包括ECD、旋光、OR、振动CD (VCD)、拉曼光学活性(ROA)等等,对现实生活中的分子(例如天然产物和过渡金属络合物)来说成为了一种切实可行的方法的时候,手性光谱的革命或者说复兴才算真正到来。手性光谱的量子力学计算使得指认绝对构型成为可能,而无需任何参考系统或任何化学衍生方法,通常不需要建立对观测性质负责的分子理化机理(所谓的光学活性机理)。就ECD而言,必须对激发态进行预测才能进行模拟,随着成本-效益非常高的含时密度泛函理论(TDDFT)方法的出现,已经向前迈出了一步[14]。高效的TDDFT可以在合理的时间内在台式PC上模拟中等大小分子的ECD谱,商业或免费软件的TDDFT ECD计算可获取性为非专家的广泛使用开辟了道路[15]。硬币的另一面是,对计算工具的黑盒使用可能很容易对结果产生意外的负面影响。在AC指认时尤其如此,显而易见,“绝对构型研究中只有两个可能的结论:要么正确,要么错误的”[6]。本文的目的是分享一下我们对TDDFT ECD计算指认有机化合物绝对构型时良好计算规范的一些思考。我们首先介绍一下完成绝对构型指认的典型流程图,然后我们通过一些示例来讨论流程中的每个步骤,以突显每个步骤中最关键的内容。
结果与讨论
典型的计算流程
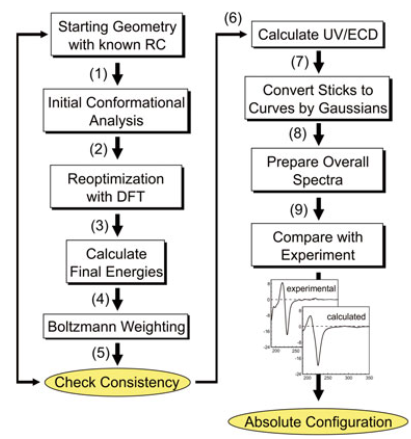
Figure 1. ECD计算流程图
对给定分子进行ECD计算的研究从输入结构的生成开始。尽管分子构象是在计算过程中确定的,但所有的其他结构特征必须事先知道,包括分子组成(所谓的“平面”结构),非常重要的是其相对构型(RC)分子中的各种手性元素。原则上,后者也可以通过手性光谱或几种方法组合来确定[17,18]。但是,我们强烈建议使用独立的工具,包括X-射线晶体学(只要有)和NMR,来尽可能地阐明RC。在大多数情况下,仔细评估对3D结构敏感的全套NMR数据,例如J-耦合(尤其是3JHH和3JCH)和NOE效应,会得出相对立体化学信息[19]。必须强调的是,在涉及柔性分子时,应该使用“真实的”分子模型而不仅仅是平面结构来合理解释NOE数据。因此,我们假定:待进行绝对构型确证的分子应该结构已知、相对构型已经确认,并且通过分子建模软件生成了该分子的初始分子模型(具有正确的相对构型!)。ECD计算研究的典型步骤如下(参见图1中的流程图)[15,20]。
(1)在低计算水平下(通常是分子力学,MM),用诸如MMFF(Merck Molecular FF)等比较好的力场进行彻底的构象搜索,以研究构象系综。这可以通过诸如蒙特卡洛或分子动力学之类的构象分析方法来完成[22]。重要的是,在构象搜索过程中,所有可旋转键以及环上的键均应被搜索到,以免错过任何可能的构象[16]。
(2a)在中等计算水平对步骤(1)中发现的所有构象体进行初步的几何优化。通常在B3LYP / 6-31G(d)理论水平完成此操作。虽然如此,我们还是建议用更有效的泛函进行结构和能量计算[23],并尽可能考虑色散校正[24]和双ζ基组。Grimme等人[25]提出的PBEh-3c方法是另一种省时高效的方法,特别是对于大分子,可以得到高质量的几何形状。本步骤的目的是对MM-结构进行筛选,并获得有限数量的低能构象,其落在某一阈值(即5或10kcal/mol)内的能量窗口中。
(2b)在更高的计算水平上对(2a)中选择的结构进行更精细的几何优化。包括:(i)使用更大的基组,例如三重ζ或考虑极化甚至弥散函数。通常,def2-SVP或def2-TZVP[26]之类的Ahlrichs基组比6-31G(d)之类的Pople基组更适合;(ii)使用溶剂模型,例如可极化连续体模型(PCM)[27],COSMO [28]或SMD[29]。
(3)可选地,将步骤(2)中找到的低能构象集在更高的理论水平进行单点能计算(例如,使用比2b步骤更大的基组),或考虑溶剂模型,和/或进行频率计算以验证找到的是真正的能量最小点并获得自由能量或零点校正(ZPC)能量。频率计算必须与几何优化在同样的级别上进行。
(4)用内能、ZPC或自由能,计算步骤(2)或(3)获得的低能构象的将Boltzmann分布[20,30,31]。最后获得一系列构象以及各自的Boltzmann分布。那些Boltzmann分布高于某个阈值(例如1%)的构象在之后的步骤中会用到。
(5)检查所计算的构象集与构象依赖的NMR数据(J-耦合,NOE接触,环电流位移)之间的一致性。在我们看来,这是非常重要的一步,在当前文献中常常被忽略。因为实验数据是几种低能构象的平均值,所以对于非常柔性的分子,此计算/实验一致性检查可能会受阻或非常复杂。这种情况可能会得益于低温NMR实验,该实验在有利的情况下可以直接对构象异构体进行定量[32]。即使在最困难的情况下,也应始终验证分布最大的构象异构体与实验结果没有矛盾,反之亦然。 如果出现矛盾,应检查构象分析是否有错并重新计算;另一方面,这也可能暗示了错误的结构指认,比如相对构型指认错误。
(6)计算在步骤(4)中发现的所有构象的吸收光谱和ECD光谱。这是整个过程中对计算要求最高的步骤,因此对计算级别的选择至关重要[9,13,14,20,33,34]。应该谨慎选择TDDFT方法泛函与基组。最重要的是,永远不要只使用单一的泛函/基组组合,而应始终探索不同的组合。至于泛函,至少应该测试两类泛函,即混合泛函(hybrid)和长程校正泛函(range-separated functionals)。越来越多的“精确”或HF交换的常用泛函有B3LYP(20%HF),PBE0(25%),M06(27%),BH&HLYP(50%)和M06-2X(54%)[35]。在ECD计算中,诸如CAM-B3LYP和ωB97X之类的长程校正泛函通常比混合泛函性能更好,因此应始终予以考虑。 HF百分比和长程间隔都会影响绝对和相对跃迁能量[36],因此正确地重现能带序列及其能量是决定最终选择的因素之一(参见下面的”TDDFT泛函的选择”部分)。至于基组,我们建议使用Ahlrichs的def2-SVP或def2-TZVP[26],或者更一般而言,建议使用具有足够宽泛极化函数的双或三-ζ基组。当里德堡态对ECD谱贡献较大时,弥散函数就很有必要[37]。通过使用下面的“TDDFT基础集的选择”一节中讨论的两种方法之一,可以轻松地验证基集收敛。 通常,计算(和实验)的ECD谱图越弱,其对计算方法(包括泛函、基组,输入的几何形状和溶剂化模型)的依赖性就越强。吸收/ECD计算的本质是激发态计算:必须以一定方式选择要包含的激发态(root)数量,以使最终计算出的吸收光谱和ECD光谱在波长校正(见下文)后能够在低于观察到的最低波长之下时很好地扩展 。
(7)步骤6的ECD计算会给出波长或能量作为旋转强度函数的列表(棒图),对每个旋转强度进行展峰并在整个光谱范围内求和得到真正的ECD图谱。ECD通常使用高斯带形(Band-shape)展宽[38]。带宽的选择,也就是高斯曲线的标准偏差,通常是在最佳拟合的基础上凭经验完成的。所谓的FWHM(半高全宽)的合理值在0.1–0.3 eV的范围内。这同样适用于根据偶极或振幅强度生成吸收光谱的情况。
(8)用步骤4得到的构象玻尔兹曼权重对步骤7获得的光谱进行加权,然后将所有加权的光谱彼此相加,得到最终的玻尔兹曼平均光谱。
(9)将实验吸收/ECD光谱与步骤8计算的全波长范围光谱进行比较。此时,可以用一个波长偏移量来对校正计算跃迁能量的系统性过高/过低估计(有时称为UV校正,因为通过比较实验值和计算得出的UV吸收光谱更容易确定系统误差)。如果匹配良好,则假定的AC为正确的AC;如果镜像图谱配体良好,则相反的AC是正确的。由于一对对映体的ECD光谱从定义上来说时镜像对称的,因此无需对一对对映体都进行计算。但是,如果进行计算,一定是精确的镜像关系。尽管计算和实验之间的比较通常是在视觉上进行的,但是我们还是建议使用工具进行定量比较[39,40]。定量比较给出相似因子,正确的AC应该比不正确的AC的相似性因子大得多(理想情况下是1比0)。如果在全波长范围内两种可能的对映异构体的比较结果均较差,则应重新检查计算流程,首先从步骤6中泛函/基组合的选择开始,直到检查第1步的构象生成步骤。
几何优化与相对能量
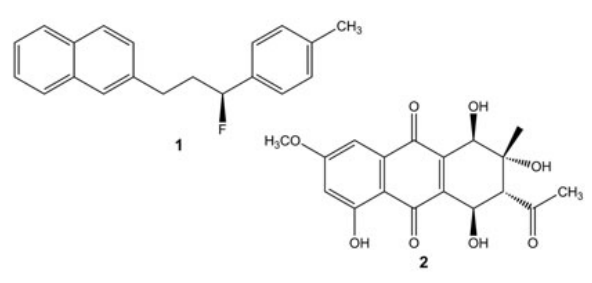
Scheme 1. (S)-2-(3-fluoro-(p-tolyl)propyl)naphthalene (1) 以及altersolanol L (2)
与QM计算分子性质有关的主要问题之一是B3LYP杂化泛函的广泛且非关键性的使用[41]。尤其是通常在B3LYP/6-31G(d)理论水平进行几何优化和性质计算(例如相对内能)。这种幼稚的方法有一些缺点,在这里不能完全解决。简而言之,一些基准研究表明,B3LYP不一定是预测标准有机分子的结构和能量的最准确泛函[23]。其他大量可用的混合泛函和长程校正泛函,包括Truhlar的M0x和Head-Gordon的ωB97类泛函在总体上表现更好[42,43]。此外,当非共价相互作用发挥作用时,对构象能的可靠预测需要包含色散,以作为对正常杂化或双杂化泛函的修正[24,44,45]。例如, 2-(3-fluoro-(ptolyl)propyl)naphthalene (1,Scheme 1)可能以展开或折叠形式存在,这取决于分子内π堆积的存在。但是,折叠构象完全被B3LYP计算所忽略,而当B2GPPLYP-D3用于真空几何优化时,折叠构象却是最稳定的构象(图2)。由于两个构象(展开和折叠)的计算得出的ECD谱图非常不同,因此它们的相对分布对计算得出的平均ECD谱图有很大的影响[10]。
Table 1. 在300 K下用五种不同方法估算altersolanol L的玻尔兹曼分布
| #a | MM | Small basisb ΔHc | Large basisb ΔHc | Large basisb ΔHc+PCMd | Large basisb ΔGc+PCMd |
|---|---|---|---|---|---|
| 01 | 78.8 | 90.5 | 46.8 | 3.2 | 0.3 |
| 02 | 15.9 | 0.0 | 0.2 | 0.6 | 0.4 |
| 03 | 2.9 | 2.3 | 5.7 | 2.2 | 1.3 |
| 04 | 1.6 | 6.2 | 42.6 | 62.6 | 71.3 |
| 05 | 0.6 | 0.0 | 0.0 | 0.0 | 0.0 |
| 06 | 0.1 | 0.0 | 0.0 | 0.0 | 0.0 |
| 07 | 0.1 | 0.3 | 3.5 | 28.9 | 25.6 |
| 08 | 0.1 | 0.6 | 0.5 | 0.5 | 0.4 |
| 09 | 0.0 | 0.1 | 0.0 | 0.0 | 0.0 |
| 10 | 0.0 | 0.1 | 0.2 | 2.0 | 0.7 |
| 11 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
a排序根据MMFF94能量,仅列出B3LYP/6-31G(d)相对能量在6kcal/mol以内的构象。b小基组:B3LYP/6-31(G);大基组:B3LYP/6-311G+(d,p)。c ΔH:分布用内能计算; ΔG:分布用ZPC-自由能计算。dPCM模型的乙腈溶液。
至于基组,尤其是由于分子内基组叠加误差(BSSE)[46-48],例如6-31G(d)之类的双ζ-Pople型基组,其精度不足以准确地计算几何形状和相对能量。至少在单点或频率计算中应考虑使用更大的基组,以估计内能或自由能(流程图中的步骤2b)。诸如标识方法的解析度(resolution of identity method)[49]或球链近似(chain-of-spheres approximation)[50]之类的节省时间方法与大型基组集组合使用或许有用。为了说明计算方法对构象分布(即使对于相对刚性的有机分子)产生多大的影响,表1报告了在300 K下用五种不同方法估算altersolanol L(2,Scheme 1)[51]的玻尔兹曼分布:(a) 步骤1MMFF级别计算的能量;(b)步骤2a在B3LYP / 6- 31G(d)理论水平计算的内能; (c)在B3LYP /6-311+G(d,p)水平计算的内能;(d)用PCM溶剂化模型考虑了乙腈的溶剂效应,在与c相同水平下计算的内能。(e)与d相同水平计算的ZPC校正过自由能。基组大小和溶剂化模型对构象分布的巨大影响警告任何人:不要将B3LYP/6-31G(d)几何优化的结果作为输入结构就直接开始ECD(或其他性质)计算。
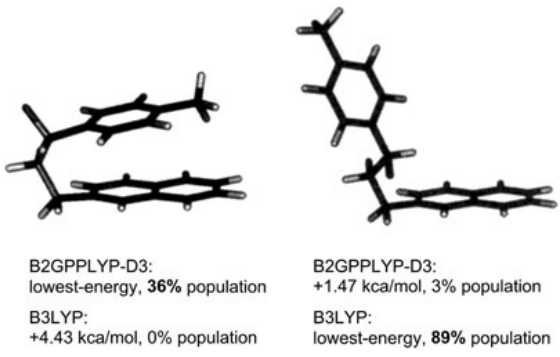
Figure 2. (S)-2-(3-fluoro-(p-tolyl)propyl)naphthalene (1)计算得到两个低能构象
图3是另一个说明性示例,展示了基组大小对相对能量以及平均手性性质(此处为旋光度)计算的影响[52]。 在这个例子中,合理的构象分布变化影响了计算的平均OR的符号,应怀疑是归属错了,应考虑使用其它方法[53]。
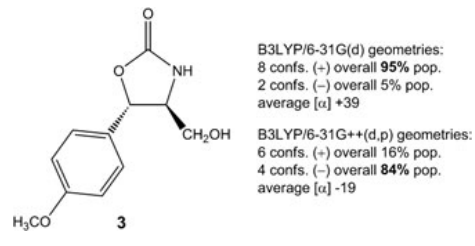
Figure 3. trans-isocytoxazone (3) 的几何优化及其后续计算的OR
在此我们要提到一种不一样的AC归属方法,它是基于在固态下测量的ECD光谱(如微晶KBr或KCl颗粒)与TDDFT使用X-衍射结构(可能经过最小化优化后)作为输入几何计算得出的结果之间的比较。 这种方法称为固态ECD/TDDFT方法,它跳过了流程图中的步骤(1-5),并且除了节省时间之外,还避免了与正确的几何形状预测有关的大多数问题。另一方面,它需要适合于X射线分析的晶体[54]。在图4的示例中,考虑到单一的固态几何结构而不是许多低能构象(20个截然不同的DFT极小点,相对内能在B3LYP/6-311G+(d,p)水平估计为3kcal/mol)来建立了天然产物(五味子乙素 A,4)的AC[55]。
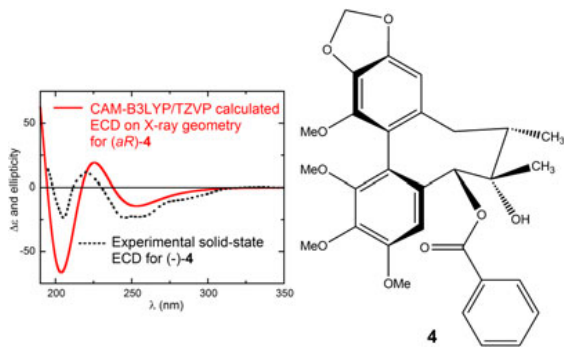
Figure 4. 借助固态ECD/TDDFT方法归属五味子乙素A(4)的AC[55]
玻尔兹曼分布
普遍采用玻尔兹曼分布来计算一组构象异构体的平均分子特性,每个构象异构体都有自己的计算特性,例如ECD光谱[20,30,31]。但是,必须注意使用 Boltzmann分布的基于以下假设:1)各种构象异构体在势能表面上彼此足够分离,也就是说,它们位于尖锐的能量阱中,其势垒高到足以将振动状态限制在每个阱中; 2)对于能阱中的所有振动状态,预测的性质(此处是ECD谱)是等效的。当涉及低频振动运动时这些近似值很容易失效,最明显的是与平坦的势相关的扭转模式,这可能会对ECD预测,尤其是OR的预测产生影响[56,57]。
要考虑的第二点是玻尔兹曼分布中使用的数量。 如上所述,几何优化或单点计算用来计算焓或内能;随后的频率计算可给出ZPC能量和自由能。原则上,后者应比内能更可靠,因为它们包含了振动熵。表1给出了使用内能和自由能获得的不同分布。但是,实际上,计算出的熵可能非常不准确,尤其是对于低能量振动,至少应使用加权因子来校正振动能[58,59]。
TD-DFT泛函的选择
正如我们在第一部分中提到的那样,选择TDDFT计算的泛函/基组是整个流程中最关键的一步。另一方面,这也是非专业人员可以轻松控制的步骤。 实际上,最重要的事情就是简单地尝试泛函与基组的不同组合,从一系列常用的泛函和合理的基组中选择即可,并验证其结果的一致性。 实际上,在此步骤中最常见、最危险的错误是仅使用单个组合,典型的做法是B3LYP配双重或三重ζ-基组,并将其结果视为理所当然。 需要强调的是,无需对构象系综进行更系统的搜索以求出最佳计算水平,而通常只需对最低能构象或少数有限的稳定构象计算即可节省可观的时间。
如果必须针对特定问题选择出”最佳”泛函,该选择是如何做出的? 不幸的是,这个问题没有普遍的答案。就激发态预测而言,与TDDFT计算一样,首先要考虑的是垂直跃迁能量和绝对振子强度[60-62]。但就完全吸收和/或ECD光谱而言,各种跃迁偶极子和旋转强度的相对能量和强度似乎比绝对值更重要。实际上,在流程图的最后步骤9中,在进行计算/实验比较时通常会同时用到波长偏移(UV校正)和强度缩放。因此,对于ECD计算的最佳性能的泛函/基组组合,可能没有通用的配方,并且选择必须依赖于试错法。一般来说,相对跃迁波长和强度都强烈地依赖于杂化泛函的HF占比和长程校正[60-62]。因此,如上一节所述,应该从两个系列泛函中选取不同的示例与一个比较好的基组(例如def2- SVP或def2-TZVP)组合对一个或多个构象分别进行测试。然后,选择图谱外观表现更好的泛函用于进一步的基组测试(如有必要的话),最后对其余构象异构体进行计算。
下面我们将讨论一些示例,旨在证明泛函对最终结果的影响,特别强调B3LYP与其他泛函之间的比较。

Figure 5. 亚砜化合物5的实验ECD图谱与不同泛函TDDFT计算的ECD图谱比较
最近的一些报告表明,在预测手性方面,像CAM-B3LYP和ωB97X-D这样的长程校正泛函优于混合泛函,首先是B3LYP[63-65]。图5的亚砜5就是一个很好的例子。CAM-B3LYP和ωB97X-D能够预测正确的ECD带(band)序列,而B3LYP则不能,尤其是因为严重低估了第1带(band)的能量[63]。当这种情况发生时,需要对跃迁和轨道进行更深入的分析,以发现可能的泛函相关问题。在化合物5及其类似物的情况下,以及在下面讨论的双卟啉系统6的情况下,导致B3LYP失效的主要因素是”缺失”跃迁的大电荷转移(CT)特性。由于不正确的渐近行为,B3LYP和许多其他混合泛函对于类CT的跃迁性能表现较差。这个问题可以通过评估特定跃迁的CT特性来证明[36,68],并且通过使用长程校正泛函来方便地处理[36,67]。
同一个例子也指出TDDFT ECD计算对混合DFT泛函中的精确交换比例的依赖性。事实上,HF%的少量增加,即从PBE0的25%变为PBE0-1/3[69]的33%,显著地改善了基于PBE的混合泛函的性能(图5b)。这说明了比较具有不同HF%的相似泛函是多么的有用,例如B3LYP(20%HF)对BH&HLYP(50%,也称为BHLYP)、PBE0(25%)对PBEO-1/3(33%)、M06(27%)对M06-2X(54%)等等。
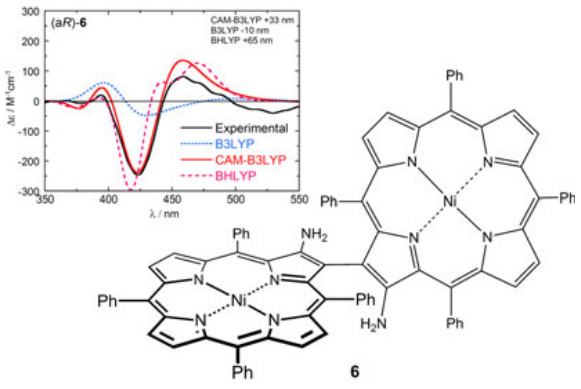
Figure 6. 联-氨基卟啉(6)的实验ECD图谱与不同泛函TDDFT计算的ECD图谱比较
另一个范例是联-氨基卟啉(6),其几何优化和TDDFT计算均对所用泛函敏感[70]。与卟啉间轴相邻的苯环位于相邻的卟啉大环上方。 只有通过色散校正的泛函(例如ωB97X-D)才能正确地重现π-堆积。 π堆积对轴的二面角以及所发现构象的ECD光谱都有很大的影响[70]。此外,CAM-B3LYP,B3LYP和BHLYP预测的ECD光谱也大不相同,只有长程校正的泛函CAM-B3LYP可以重现正确的模式、强度和实验曲线的符号(图6)。 由于CT相关的问题导致B3LYP性能表现不佳的原因已经讨论过。
TD-DFT基组的选择
TDDFT计算的基组选择原则上不如自由能的计算那么关键。振子和旋转强度值对基组不是很敏感,此外,两种简单的实用方法可能有助于解决这一问题。首先,当接近基组完备性时,根据偶极长度(DL)和速率(DV)形式方程计算的旋转强度会相互收敛[71],并且大多数软件包都提供了DL和DV旋转强度的结果用于直接比较。其次,可以用一个代表性的构象异构体进行多个TDDFT计算,保持泛函不变并增而增加同一系列基组的大小,例如,使用SVP,TZVP,最小增强的TZVP(ma-TZVP)和增强的TZVP(aug-TZVP)[26,72],并寻求最佳的成本-准确性折衷方案。通常,双或三-ζ非增强基组已经给出了可靠的结果,但是当涉及里德堡态[37]或阴离子时,需要使用弥散函数。除了计算成本外,弥散函数通常还会导致SCF中线性相关性严重的问题,从而导致收敛问题。 Truhlar等人[72]提出的最小增强基组(例如,ma-TZVP,ma-cc-pVTZ)就是一个很好的折衷方案,它以与大型增强基组具有几乎相同的精度但显着降低了计算成本[73]。
更困难且因此更决定性的关键点是激发能的计算,因为它们对基组的敏感性更高,这取决于所研究的生色团性质。为了获得正确的绝对值,基组必须非常大,包括极化函数和弥散函数,请记住,跃迁能量还取决于所采用的泛函[60-62]。但是,如上所述,用于确定绝对构型不需要获得正确的绝对能量值,而是相对能量必须可靠。 对于较小的基组,实验光谱和加权平均光谱之间的系统偏移通常较大,但步骤9中提到的UV校正足以处理此问题。
溶剂化模型
溶剂对ECD光谱的影响通常不如对其他手性光谱(例如OR,VCD和ROA)剧烈。尽管如此,溶剂仍可能影响构象的相对稳定性和组分ECD谱图[74]。在DFT几何优化和TDDFT计算过程中,非特异性溶质-溶剂相互作用可用诸如PCM[27]或COSMO[28]之类的连续溶剂模型来解释。其计算成本十分合理。 相反,特定的溶质-溶剂,溶质-溶质或分子内相互作用需要使用更苛刻的显式溶剂化模型[74]。
限于篇幅,本文不能详尽地讨论溶剂的影响。在ECD计算中是否应考虑溶剂模型等看似简单的问题,并非无关紧要。保持非常务实的立场,我们建议在构象能的单点计算中(流程图中的步骤3)以及对选定的构象进行TDDFT计算时使用连续溶剂模型,至少对中等极性的分子应考虑与极性溶剂结合使用。表1时一个PCM对构象分布的影响的例子。至于TDDFT计算,PCM尤其会影响相对跃迁能量,并且可以在计算出的ECD频段之间有更佳的间隔。
仅当其他方法都失败时,才考虑使用显式溶剂模型。例如,在流程图的步骤(5)中,计算出的构象系综与独立的实验结果(例如NMR数据)相矛盾。 通常,这是由于缺少分子内相互作用(例如在溶液中发生π堆积或氢键),或由于强的特定溶质-溶剂相互作用(例如水中的氢键)引起的。 他们的正确模拟需要在构象搜索,几何优化和TDDFT计算步骤中考虑显式的溶剂分子。此类计算非常复杂且计算量很大,我们请感兴趣的读者阅读相关参考文献[74-77]。
不只是TD-DFT
鉴于TDDFT目前非常流行,我们将TDDFT作为ECD计算的方法进行了讨论。然而,对于作为TDDFT进行激发态计算的替代方案,特别是在某些情况下,其他几种方法也是可行的[10,11,13,33,34]。尽管传统TDDFT非常高效节时,但计算较大分子的ECD却不可行。在此,新开发的简化TDDFT(sTDDFT)方法是一种非常有效的替代方法,其允许以有限的计算成本以良好的精度对多达1000个原子的分子进行ECD计算[78]。TDDFT的另一个问题是具有严重的长程CT激发的发色团,其难以由任何泛函处理。在这种情况下,可以采用SCS-CIS(D)、耦合簇方法CC2或EOM-CCSD等其他方法[79,80]。在ECD计算中,CC2尤其受到了关注[81-83]。与TDDFT类似,耦合簇方法不能处理多参考波函数。 MRCI(Multiple reference Configuration Interaction)技术的使用对于单个电子构型不能完全描述的分子是必要的[84]。然而,这些方法非常耗时,特别是MRCI,只有经验丰富的用户才可驾驭。
结论
手性性质的量子力学计算是目前用来归属几类分子(特别是小或中等大小的天然产物)绝对构型(AC)的容易获得且强大的工具。然而,ECD光谱的TDDFT计算的良好计算规范有待推广,以避免在AC归属时出现不希望的错误并且有利于计算方法的使用。我们的讨论已经阐明一个关键点是:没有任何计算方案在所有情况下对所有分子都普遍有效。特别是,不鼓励采用非常流行的”B3LYP/6-31G(d)”方法,尽管它很可能正确归属AC。目前得到的最重要的信息是:每种计算方法都容易出错; 因此,人们不应该局限于单个计算级别,并且应该总是探索例如不同的DFT泛函和基组组合。第二个关键点是:我们认为,完全依靠计算方法是不够的,特别是在输入结构的生成方面。在计算机上获得的构象系综应始终与NMR等其它技术获得的所有实验数据进行核对。我们还建议通过一套完整的J耦合和NOE测量,通过X射线衍射或NMR对相对构型进行独立评估,其解释应得到分子模型的支持。最后,在比较实验和计算的ECD光谱的时候,不应只是关注单个波段或某个窄波长窗口,而是考虑整个可用的波长范围。在该步骤中,也优选定量光谱比较而不仅仅是视觉光谱比较。



