摘要:在基于结构的药物设计中,人们通常对配体进行优化以取代蛋白质结合口袋中能量不利的水分子。另一方面,焓有利的水分子可以被视为蛋白质和配体之间的介质,蛋白质-水-配体的相互作用在结合过程中也很重要。因此,了解结合位点水的稳定性对于成功的基于结构的药物设计至关重要。本文介绍了如何利用Flare的GIST来分析apo与holo结合位点的水能量学特征,并以此来指导新的分子设计。
作者:Qi Yuan/2022-07-15
编译:肖高铿
水在蛋白质-配体结合过程中的作用至关重要。 在基于结构的药物设计中,人们通常对配体进行优化以取代蛋白质结合口袋中能量不利的水分子。另一方面,焓有利的水分子可以被视为蛋白质和配体之间的介质,蛋白质-水-配体的相互作用在结合过程中也很重要1。因此,了解结合位点水的稳定性对于成功的基于结构的药物设计至关重要。
使用GIST对水分子进行计算建模
可以通过计算来确定水在蛋白质-配体结合位点内的行为。在Flare™中实现的水分析方法之一是GIST(Grid Inhomogeneous Solvent Theory)2。使用显式水对蛋白质进行约束的分子动力学模拟,并使用非均匀溶剂化理论 (inhomogeneous solvation theory,IST) 计算预定义体积(通常是结合位点)的水分子分布和热力学性质。
一阶熵和一阶和二阶能量可以从IST理论中获得。溶剂化熵近似为溶质-水相关性,如公式 (1) 所示,其中kB是玻尔兹曼常数,ρo是本体溶剂(bulk solvent)数密度,gsw(r,w) 是溶质-水对相关函数。
$$\Delta S_{solv} \approx \Delta S_{sw} \equiv -k_B{\rho^o \over {8\pi^2}}\int g_{sw}(r,w)drdw\cdots (1)$$
溶剂化能ΔH是通过相对于本体水的水-水能量和用MD力场计算的溶质-水能量得到的。溶剂化自由能可用下式(2)计算:
$$\Delta G = \Delta H – T\Delta S \cdots (2)$$
水密度和上述热力学性质的三维映射是从GIST计算中生成的。三维网格图可以突显出水稳定性高或低的区域,这可以用作揭示水合位点和指导计算机辅助配体设计的工具(图 1)。
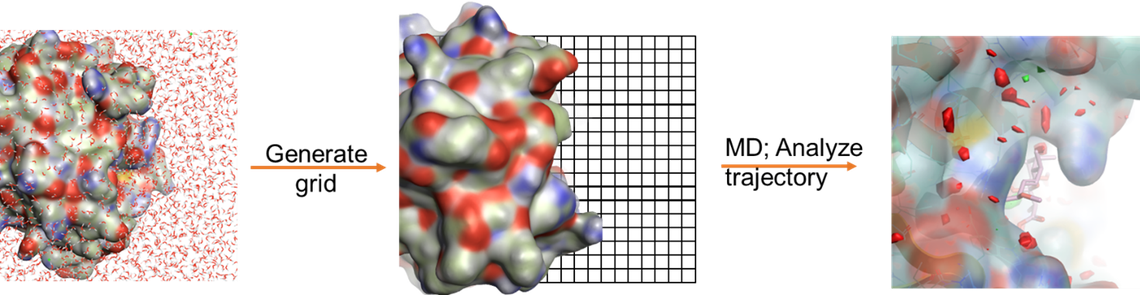
图1. GIST计算的工作流程以及计算获得的水稳定性热表面图。
在Flare V6中使用GIST计算来增强水的分析
GIST在蛋白质-配体结合和配体设计中的应用仍在探索中。在Flare V6中,GIST计算的水分析功能提供了多角度的指导,例如去溶剂化、能量和熵的贡献。
GIST水分析实验算例
PDB 3RLP为HSP90与配体4-(2,4-二氯-5-甲氧基苯基-6-甲基嘧啶-2-胺的共晶结构。对PDB 3RLP结合位点apo结构与holo结构的GIST水分析实验结果分别如图2(apo结构,配体仅供参考)和图3(与holo结构)所示。从图2a可以看出,水分子4和预测的水9490都是具有正溶剂化自由能的“unhappy”水,表明这些两个水分子可以用配体中的片段取代或置换。然而,这两个水分子都是焓“happy”的,表明它们与蛋白质或周围水分子具有强烈的相互作用。出于配体设计的目的,正确放置且与环境具有相似焓相互作用的极性官能团可以用来取代此类水分子。
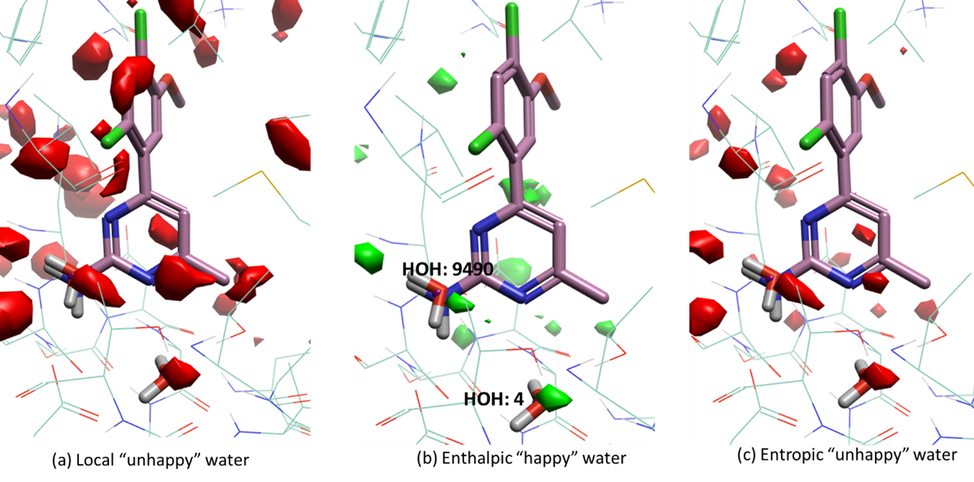
图2. 对Hsp90的apo结合位点(PDB 3RLP)进行GIST分析的计算结果。(a) “local happy water”等值面,其中水密度大于等于4,ΔG小于等于-0.5kcal/mol。 (b) “enthalpic happy water”等值面,其中ΔH小于等于-2 kcal/mol。(c) entropic unhappy water等值面,其中-TΔS大于等于2kcal/mol。
对apo结合位点的GIST分析可以发现,如图2a所示,配体的嘧啶氨基被红色的local unhappy water等值图覆盖,该等值图与预测水9490重合(图2b)。这说明,预测的水分子9490被配体的氨基取代,氨基可以与环境发生焓相互作用。这个预测的水9490可被HSP90的另外两个晶体结构(PDB 2YE5与2YE8)所证实。然而,根据对holo结合位点的GIST计算结果(图 3),水分子4位于holo结构中local happy water的热图附近。从图3b和3c可以看出,水分子4是焓“happy”的,焓贡献大于熵损失,这表明水分子4是桥接水分子,在蛋白配体结合过程中被稳下来,或者说水分子4介导了蛋白与配体之间的相互作用。
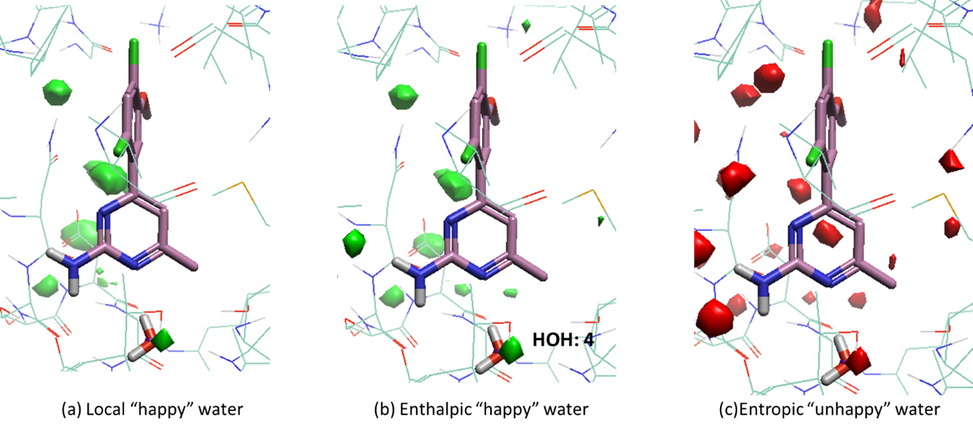
图3. 对Hsp90的holo结合位点(PDB 3RLP)进行GIST分析的计算结果。(a) “local happy water”等值面,其中水密度大于等于4,ΔG小于等于-0.5kcal/mol。 (b) “enthalpic happy water”等值面,其中ΔH小于等于-2 kcal/mol。(c) entropic unhappy water等值面,其中-TΔS大于等于2kcal/mol。
配体与周围环境的相互作用图如图4中的2D图所示。配体的嘧啶氨基替换了预测高能水分子9490(见图1),与ASP93A以及水分子1之间形成了氢键相互作用。在配体的嘧啶环氮原子和水分子4之间形成了弱氢键详相互作用,这稳定了水分子(如图3a所示)。
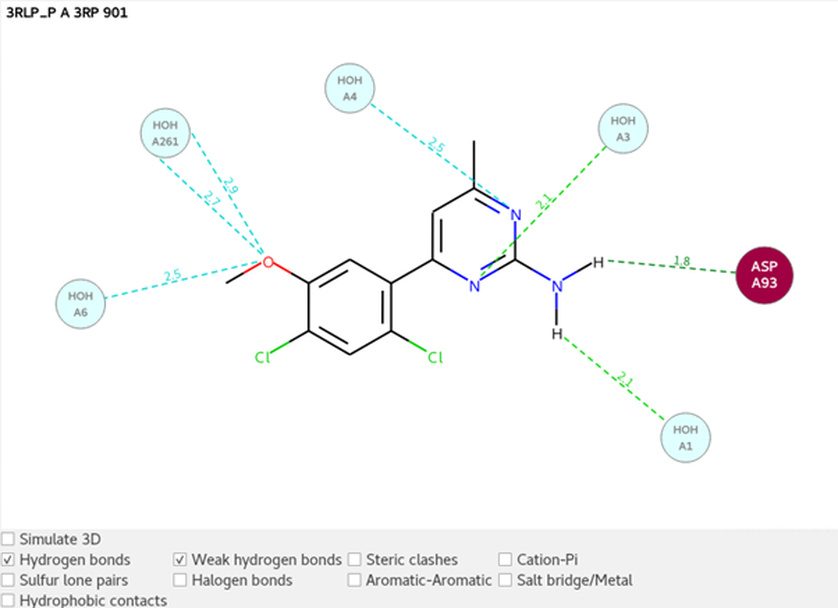
图4. 配体与周围环境的2D相互作用图,其中突出显示了PDB 3RLP中的氢键相互作用。
结论
GIST计算易于设置和运行。在Flare V6中,对GIST结果显示进行了改进。使得结合位点水的解释变得更加容易。它增强了计算化学家了解活性位点中水的性质以及这些水的稳定性对配体结合的影响。
文献
- Mahmoud, A. H.; Masters, M. R.; Yang, Y.; Lill, M. A. Elucidating the Multiple Roles of Hydration for Accurate Protein-Ligand Binding Prediction via Deep Learning. Commun. Chem. 2020, 3 (1), 1–13.
- Nguyen, C. N.; Kurtzman Young, T.; Gilson, M. K. Grid Inhomogeneous Solvation Theory: Hydration Structure and Thermodynamics of the Miniature Receptor Cucurbit [7] Uril. J. Chem. Phys. 2012, 137 (4), 44101.



