从构象稳定性与水分子替换角度理解PARP1抑制剂HRS1167的设计
摘要:本文用Flare的QM计算与GIST水能量学计算分析了Parp1抑制剂HRS1167大环化设计。HRS1167的大环设计一方面稳定了结合构象,对活性有利;另一方面,大环氧原子对稳定的结合水1222进行了替换而对活性不利。两方面贡献互相抵消后的综合贡献是对活性不利,导致HRS1167的活性比比AZD5305稍差,IC50分别为19与3nM。
肖高铿/2023-11-23
前言
在公众号新药故事发表的《恒瑞的PARP1抑制剂HRS1167的药物设计》1分析了HRS1167可能的结构以及其分子设计策略。从公开的数据上看,如图1所示,WO 2022/247816 A1(以下简称专利7816)的实施例8具有优于AZD5305的选择性,因此是HRS1167的可能结构之一。
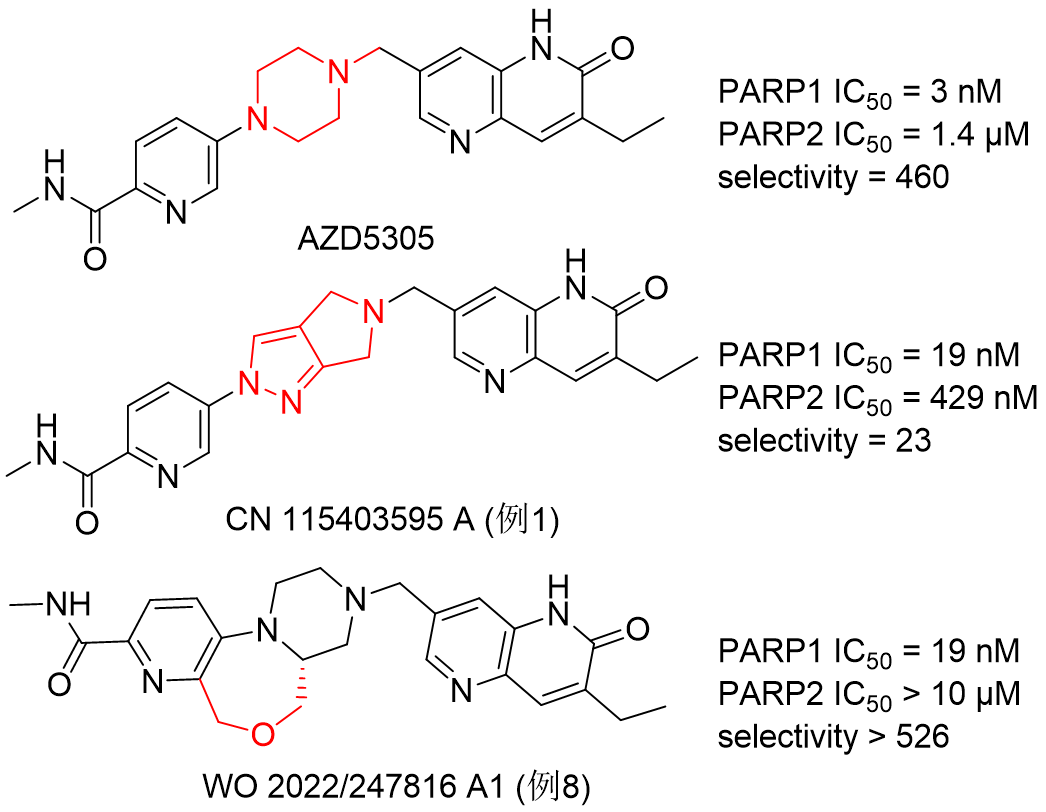
图1. HRS1167可能的化学结构式
专利7816实施例8是AZD5305的大环化设计,本文的主要目的是回溯性地用Flare的量子化学扭转角分析与水能量学特征分析来理解从AZD5305出发到HRS1167大环化的优化机会及其面临的挑战。
Flare QM扭转角分析发现AZD5305的优化机会
在前文中2,我们讨论了如何用Flare QM3的Torsion Profile来发现能量过高的两面角并用于解释相似分子的活性差异。我们可以用同样的方法来分析AZD5305的生物活性构象,从中发现高能的两面角作为亲和力优化的机会。
AZD5305的生物活性构象可以从与它相差一个芳香N原子的同系物共晶结构PDB 7ONT出发,用Flare编辑器简单替换一个原子后可得。然后用Flare QM的Torsion profile对吡啶-哌嗪片段的C-N键在B3LYP-D3BJ/6-311+G(d,p)理论水平进行扭转角分析,结果如图2所示。
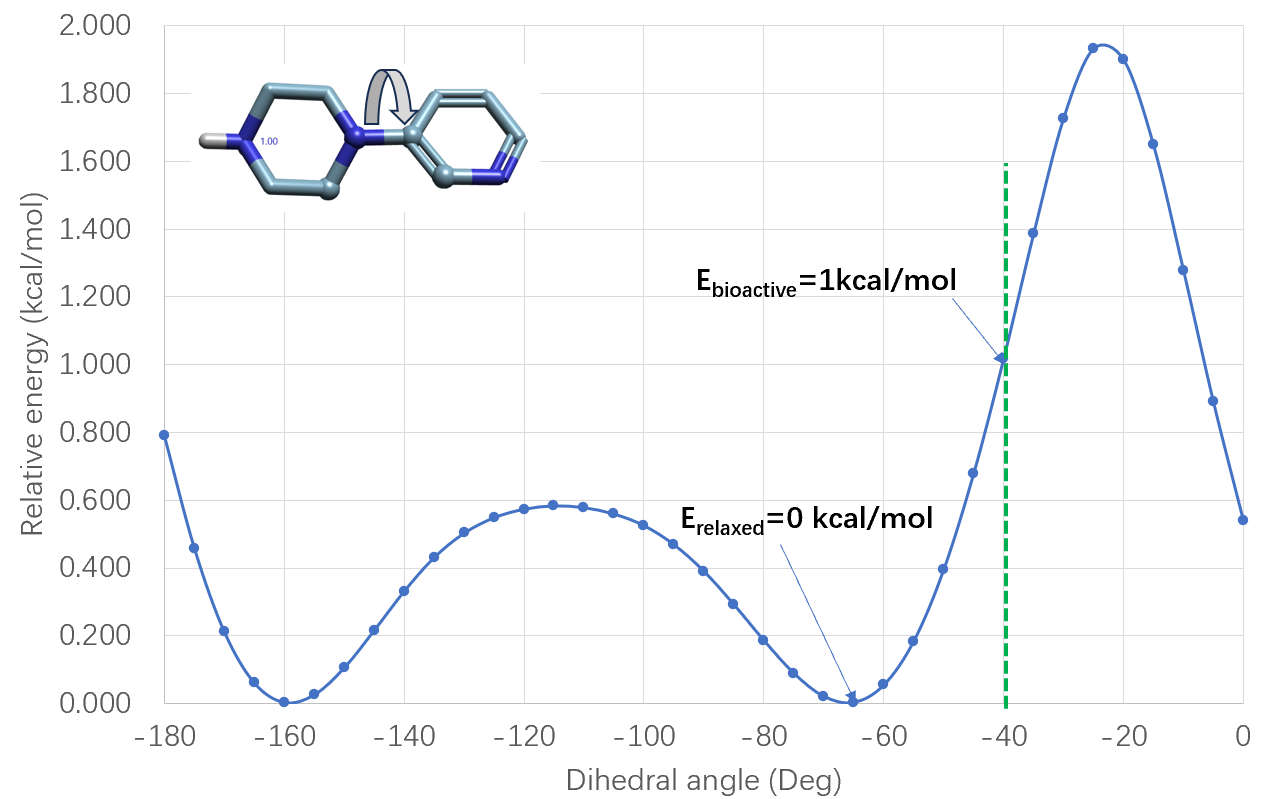
图2. 在B3LYP-D3BJ/6-311+G(d,p)理论水平对吡啶-哌嗪片段的C-N键进行两面角分析结果
结果表明,生物活性构象N-C两面角为-41°,经过几何优化后的两面角为-66°,两者能量相差大约1kcal/mol,这说明生物活性构象在能量上是不利的,因此采用大环化结构将活性构象稳定下来将有利于保持结合亲和力。
然而,与预期相反,大环化后的专利7816实施例8的IC50=19nM,是AZD5305(IC50 =3nM)的6.3倍,这说明在大环化稳定活性构象的同时引入了对活性不利的因素。
置换稳定的结合水1222抵消了大环稳定构象带来的益处
可视化分析PDB 7ONT的结合位点,如视频1所示,可以发现该结合口袋里填充了很多的水分子,这些水分子与蛋白、配体以及其它水分子形成氢键网络。尤其注意到HOH1222(红色球状氧原子),它不仅靠近配体的哌嗪环,也介导着水-水-蛋白的氢键网络。
视频1. ADZ5305对接到PDB 7ONT结合位点里的结合模式及其氢键网络,其中水1222的氧原子显示为红色球状
视频2显示了HRS1167对接到PDB 7ONT结合位点后的结合模式以及结合位点里的氢键网络,其中大环的氧原子替换了水1222,并与其它水发生氢键相互作用。因此,大环化除了稳定结合构象之外,还有涉及水1222的替换效应。问题是这个水的替换对结合有利还是不利?
视频2. 显示了HRS1167对接到PDB 7ONT结合位点后的氢键网络与结合模式
为了理解HOH1222的能量学特征,用Flare对PDB 7ONT的结合位点进行了GIST分析4,结果如图3所示,HOH1222不仅被高密度水覆盖(未显示),而且计算的水合自由能小于-2.0 kcal/mol。
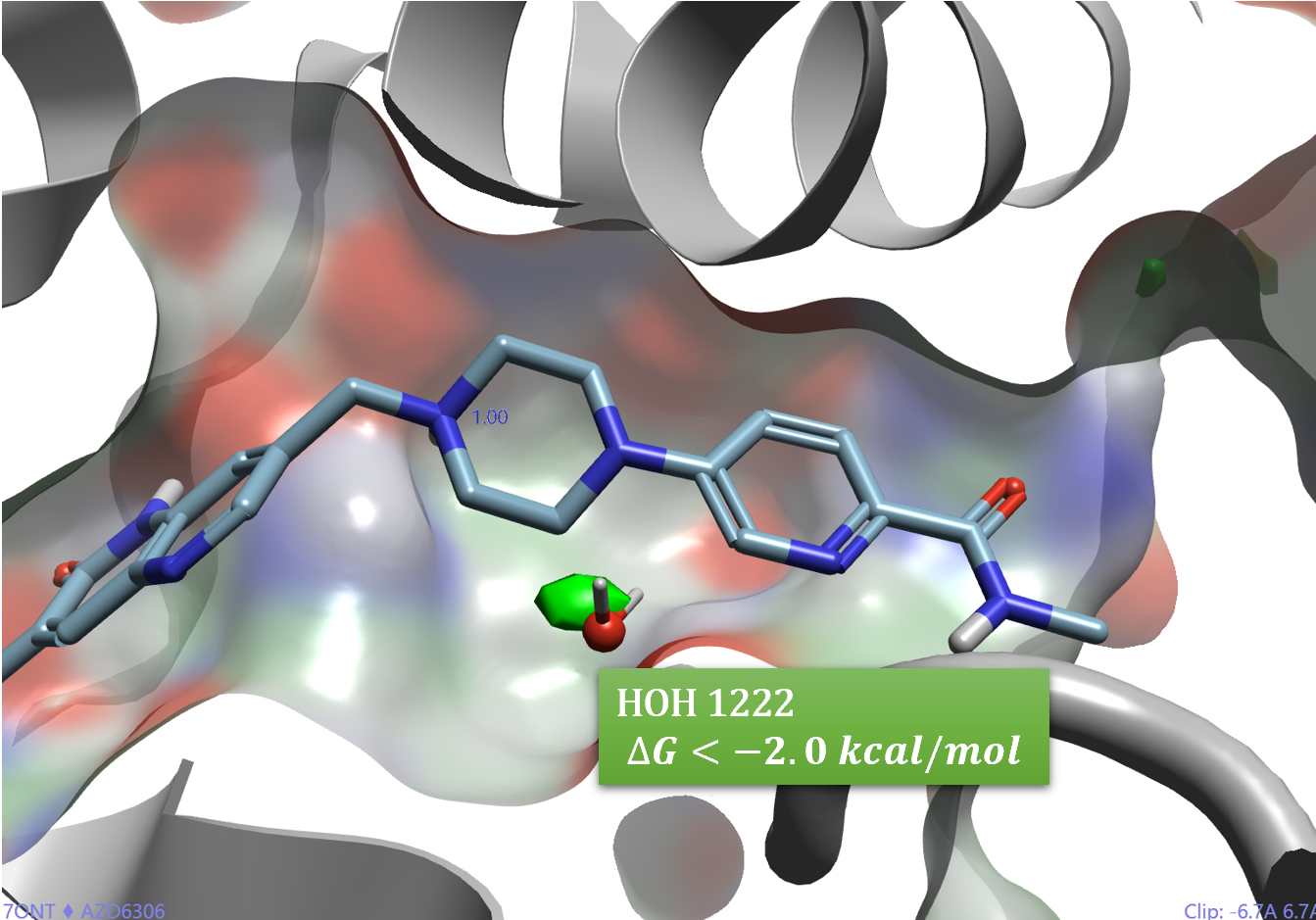
图3. PDB 7ONT的HOH1222是一个水合自由能小于-2kcal/mol的稳定水
HRS1167结合模式(Flare docking对接计算)表明,大环上的氧原子刚好被水合自由能=-0.5kcal/mol的等值图覆盖,如图4所示。大环连接臂的氧原子替换了结合位点里的水分子1222,这意味着将在结合自由能上付出不低于2kcal/mol代价而对结合不利。
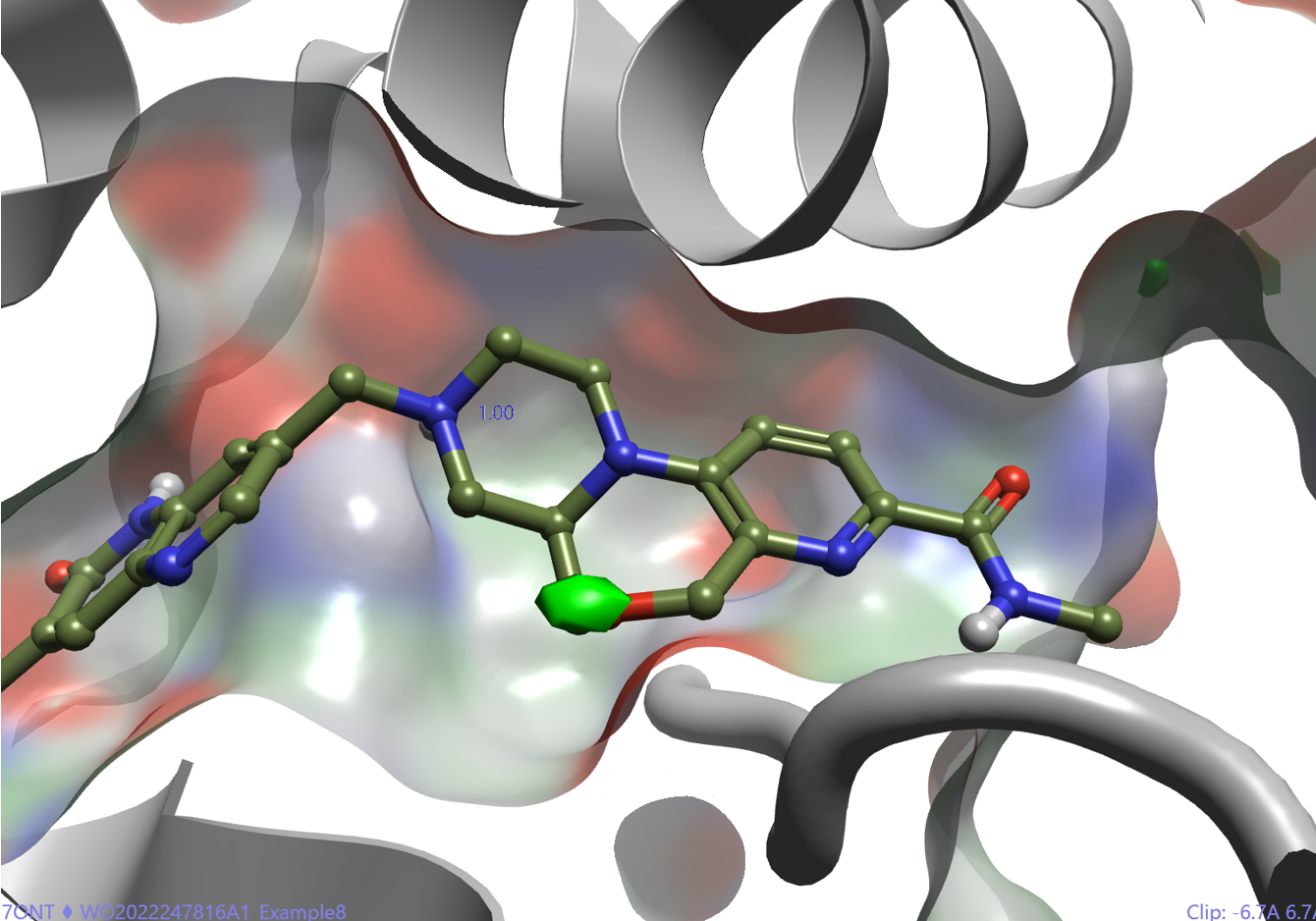
图4. HRS1167大环的氧原子替换了PDB 7ONT的HOH1222,被水合自由能=-0.5kcal/mol的等值图覆盖
小结
总的来说,Flare的QM计算与GIST水能量学计算可以帮助我们进一步理解HRS1167大环化设计。HRS1167的大环设计一方面稳定了结合构象,对活性有利;另一方面,大环氧原子对稳定的结合水1222进行了替换而对活性不利。两方面贡献互相抵消后的综合贡献是对活性不利,导致HRS1167的活性比比AZD5305稍差,IC50分别为19与3nM。
此外,处理稳定结合水的另一种方式是将它作为蛋白的一部分,设计配体与之发生相互作用。因此我认为这里还有优化的机会,并期待将来看到这样的Parp1抑制剂设计。
文献
- drugStory.2023-11-15.恒瑞的PARP1抑制剂HRS1167的药物设计.微信公众号新药故事.
- 肖高铿. 势能面扫描在Torsion Profile中的应用. 墨灵格的博客. 2020-01-30. http://blog.molcalx.com.cn/2020/01/30/qm-torsion-profile.html
- Flare QM. http://www.molcalx.com.cn/cresset/flare/flare-qm
- Flare GIST. http://www.molcalx.com.cn/cresset/flare/3d-rism-and-gist
联系我们,获取软件试用
想要亲自尝试,您可申请Flare试用版。



