摘要:本文以BMS公开的6o化合物为起点,经SPARK进行骨架跃迁、Hit Expander的快速结构修饰,再进一步通过简单结构生物学信息与DMPK性质判断,以计算方式重现TYK2 JH2抑制剂NDI-034858的设计。
肖高铿/2022-12-23
前言
2022年12月13日,武田制药发布收购Nimbus制药的TYK2抑制剂NDI-034858(图1)的公告[1]。根据协议条款,武田公司将向Nimbus公司支付40亿美元的入门金,并在年净销售额达到40亿美元和50亿美元时分别支付10亿美元的阶段性付款。

图1. NDI-034858及其相似化合物的化学结构
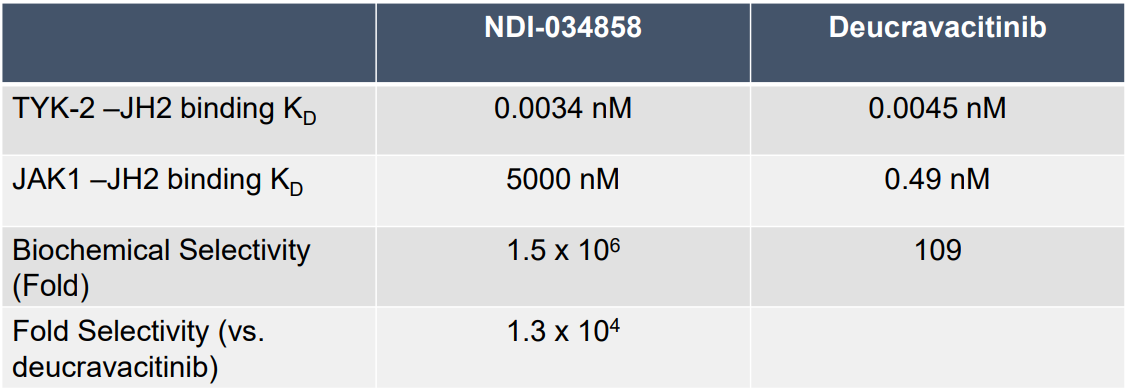
与NDI-034858最相似的TYK2抑制剂当属BMS发表的系列结构[2]中的6o(图1),与之属于同一系列还有6与6c(图1)。其中6具有非常好的成药性[2],而6c已经发布了共晶结构,其PDB代码为6NSL。显而易见,NDI-034858与6c在结构上的差异在于骨架,可以认为前者是后者的跟进型开发。根据Nimbus在SID 2022年会上的poster[3],NDI-034858开发时设立的竞品为BMS的Deucravacitinib,主要优势体现为对JAK1 JH2的选择性上。如表1所示,NDI-034858对JAK1的Kd为5000nM,而Deucravacitinib为0.49nM。
表1. NDI-034858与Deucravacitinib的TYK2/JAK1 JH2选择性比较
我关心的是能否用简单的方法实现从6o到NDI-034858的设计。因此,本文的主要目的是:借助计算工具Flare与SPARK实现从6c到NDI-034858的骨架跃迁,并实现TYK2/JAK1 JH2的选择性设计。最终希望这些方法可以在相似的场景下为大家的项目提供帮助。
6o的结合模式预测与靶标选择性设计的初步思考
6o的结合模式可以用Flare读入6c-TYK2复合物(PDB 6NSL),在结合位点内直接对6c进行编辑得到6o,并以蛋白为背景用力场(OpenFF 2.0)进行结构优化(不考虑共晶水)可获得几个可能的结合模式。
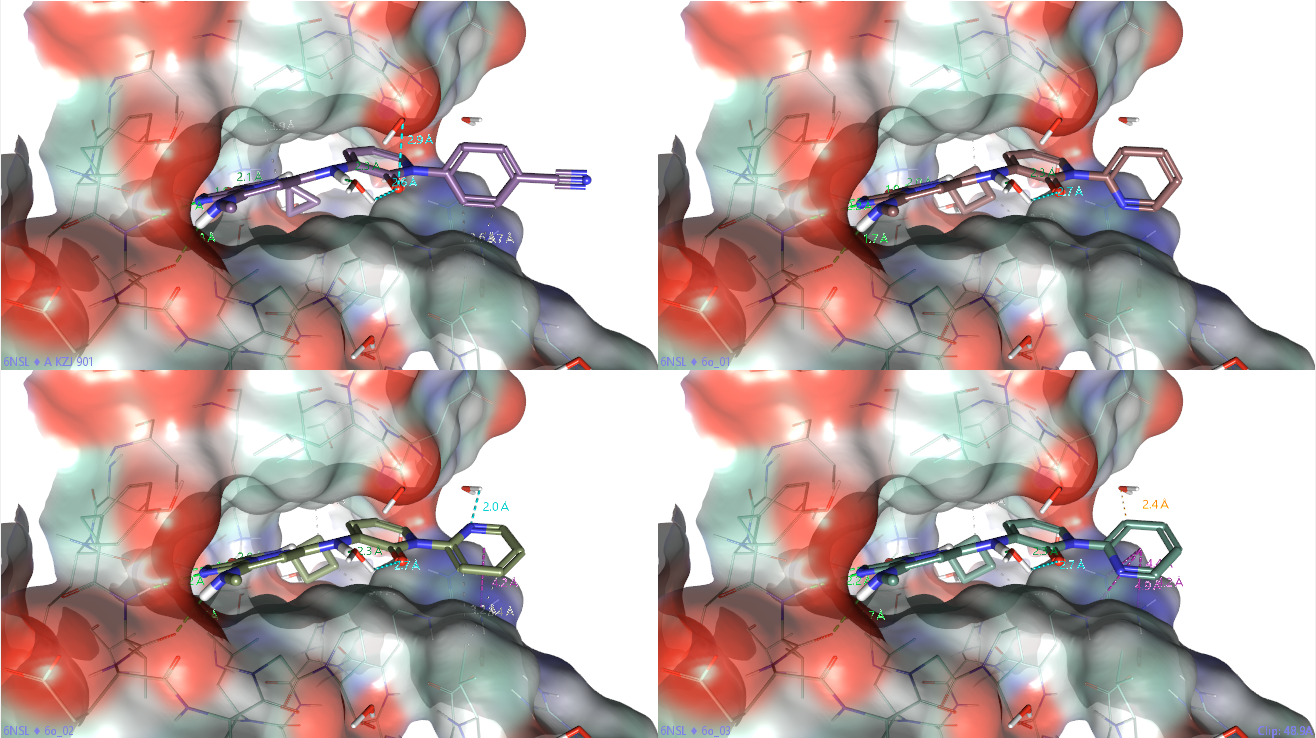
图2. 化合物6o在TYK2 JH2结合位点里可能的结合模式。左上:6c的共晶结构;左下、右上与右下:6o的3个不同结合模式。
不同pose的最大区别是吡啶的取向,绕着吡啶酮与吡啶的N-C轴向旋转,有三个可能取向,如图2所示。其中图2左下的结合模式我认为更为可能,进一步呈现为图3的视频,之后的骨架跃迁实验以及TYK2 JH2/JAK1 JH2的选择性设计等如果没有特别说明,都以这个pose为基础。当然还有其它相当合理的pose,比如,在保持其它相互作用不变的情况下,吡啶环氮可以靠近HOH1029并将之替换,作为氢键受体与GLN597的酰胺NH发生氢键,这里没有呈现。
图3. 化合物6o与TYK2 JH2的结合模式(预测)
将JAK1 JH2叠合到TYK2 JH2上,比较两者结合口袋的差异将为设计选择性抑制剂提供有益的思路。在Flare里下载PDB 4L01,在准备之后,进行序列比对,并叠合到PDB 6NSL上,结果如图4所示。
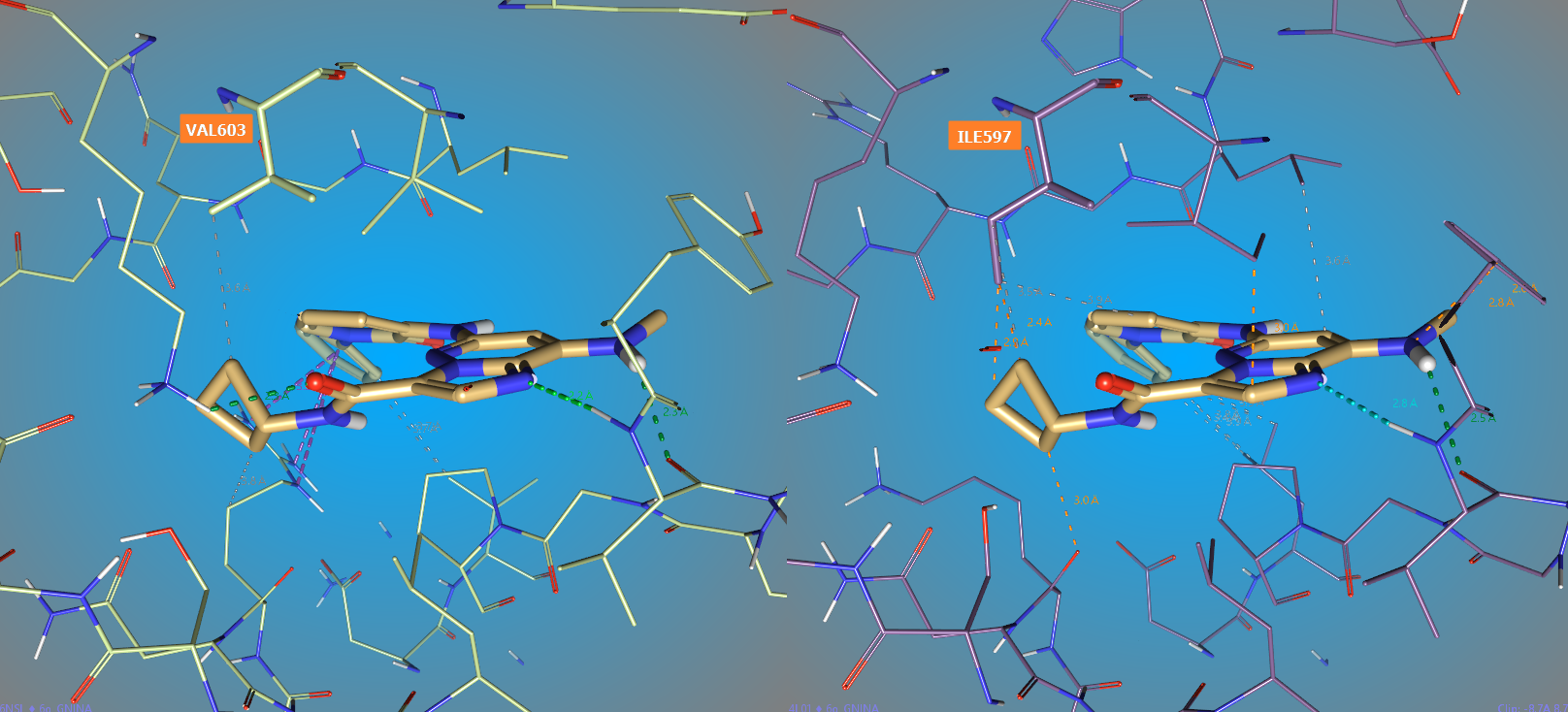
图4. TYK2(右,PDB 6NSL)与JAK1(左,PDB 4L01)的 JH2结合口袋比较,其中水分子已经被隐藏不显示
如图4所示,在结合口袋靠近6o环丁烷基附近,TYK2的VAL603残基与JAK1 ILE597残基具有显著的差异:JAK1的ILE597与环丁烷具有明显的立体碰撞,这对6o的结合不利;而TYK2相对来说具有更大的空间,可以容纳更大的基团。因此,在环丁烷上引入体积更大的基团是降低对JAK1 JH2结合亲和力以提高靶标选择的关键。考虑到6o系列化合物在DMPK上的特点是疏水性强则代谢不稳定,因此引入具有一定极性成分的甲氧基以保持角度logp是为数不多的选择。而且这个立体基团应该加在环丁烷酰胺的邻位反式位置上,这样才能最靠近JAK1的ILE597以形成最大的立体碰撞效应。那么,可以初步设计出一个靶标选择性可能得到提高的化合物6x(图5),当然6x是我命名的,不在BMS的文献里。
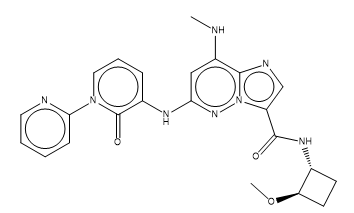
图5. 一个靶标选择性可能得到提高的设计化合物6x
BMS与Nimbus的TYK2 JH2抑制剂在结构上的相似性几乎到了显而易见的地步,这也许只是英雄所见略同的巧合。让人困惑为什么一直没有BMS对6系列化合物[2]进行进一步开发的信息,也让人好奇在NDI-034858成功的基础上,是否会进一步快开发。
6o的骨架跃迁
骨架跃迁通过SPARK V10.7来实现。以6o为起点,如图6所示,被替换的部分被高亮显示。
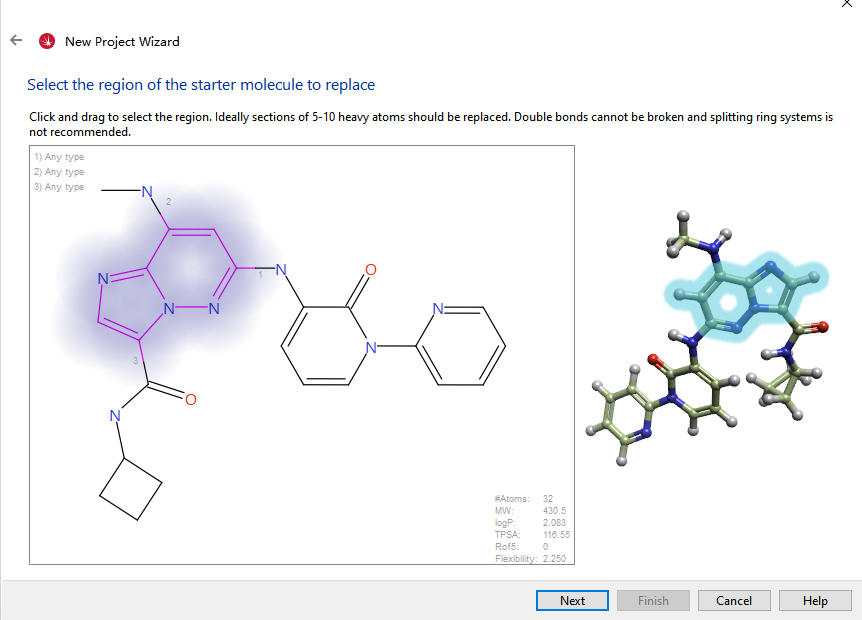
图6. 6o作为骨架跃迁的起点分子,高亮部分是要被替换的骨架
为了让搜索更具针对性,还对母核五元环的一个氮原子做了药效团约束。如图7所示,箭头指示那个氮原子设置为氢键受体,这使得新骨架在同样的位置上具有氢键受体。
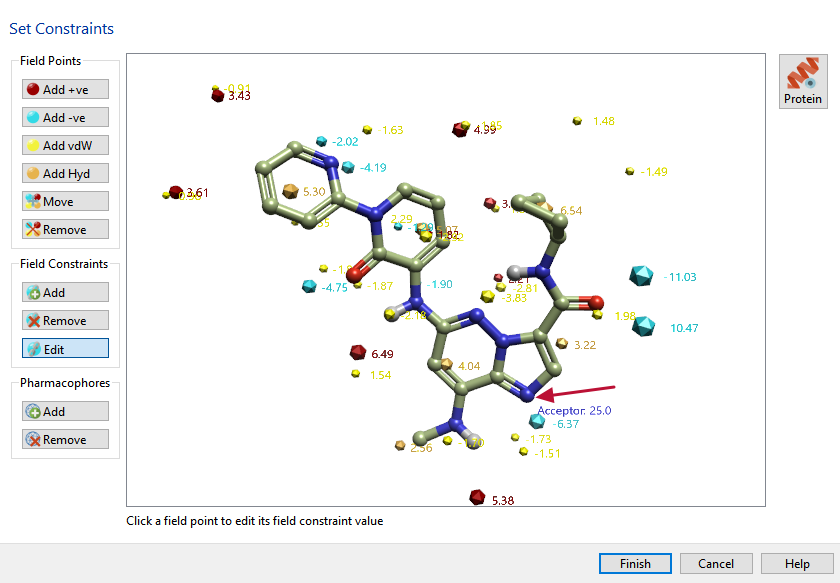
图7. 设置药效团约束条件
骨架跃迁是通过对片段数据库的虚拟筛选来实现,本次实验用的打分函数为默认的Spark相似性打分(场与形状),该打分函数在礼莱科学家的一项研究中表现出比其它所有方法都更优秀的性能[4,5]。在对数据库进行搜索时还读入蛋白作为体积排除条件,然后,对三个常见片段数据库进行搜索(图8):
- ChEMBL_Common
- Commercial VeryCommon
- Commercial Common
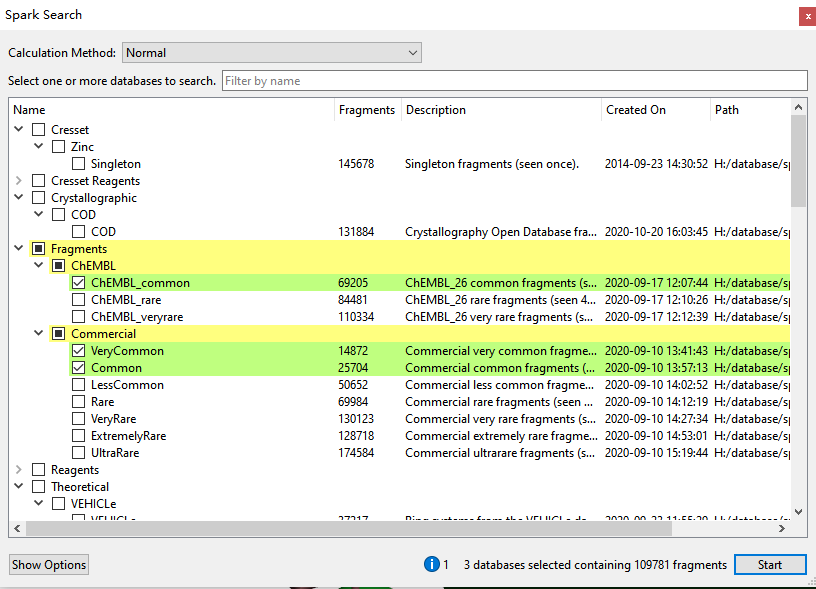
图8. 骨架跃迁用的三个数据库
整个计算在我的笔记本上,大约2分钟就完成,共搜索到143个片段,其中有34个片段(对应18个不同骨架)的BIF%大于60,score大于0.7。这意味,有18个骨架值得我们进一步分析。结果发现,排名第一的骨架与6o自身是一样的,排名第二的是Nimbus NDI-034858骨架,如图9所示。
图9. 6o的骨架跃迁结果
排名第二的Nimbus吡唑并嘧啶骨架来源自ChEMBL Common数据库的CHEMBL178785(图10),这个片段在SPARK数据库不同的1350个分子里出现,因此是常见片段。SPARK并没有利用任何关于TYK2抑制剂的结构信息而给出相关骨架。
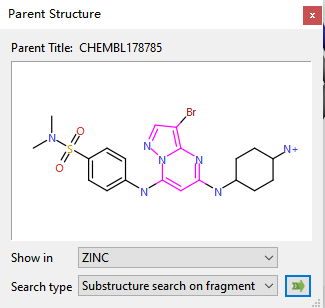
图10. 骨架跃迁排名第二的吡唑并嘧啶骨架母体化合物
总的来说,在本次骨架跃迁实验中,获得的打分排名第二的化合物(图11)可作为下一步hit expansion的起点。
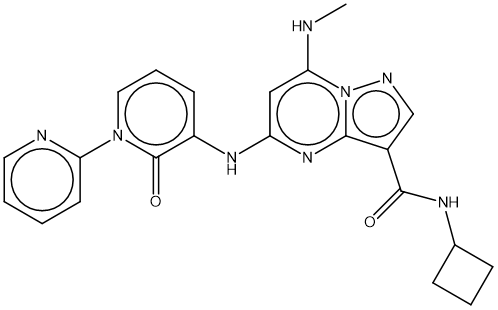
图11. Spark打分排名第二的化合物Rank 2
Hit expansion:用Hit expander对Rank 2化合物进行衍生化,提高靶标选择性
由于化合物Rank 2与6o具有完全一样药效团,可以预计两者具有同样的结合模式,分子对接结果显示确实如此,2D相互作用图如图12所示。
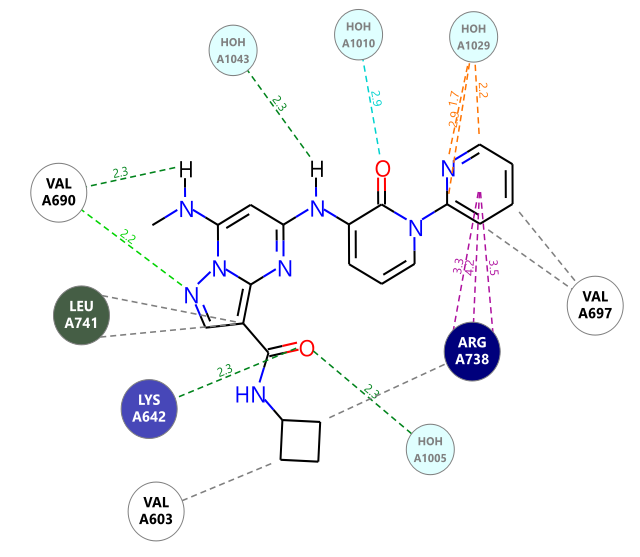
图12. Rank 2与TYK2 JH2的相互作用模式2D图
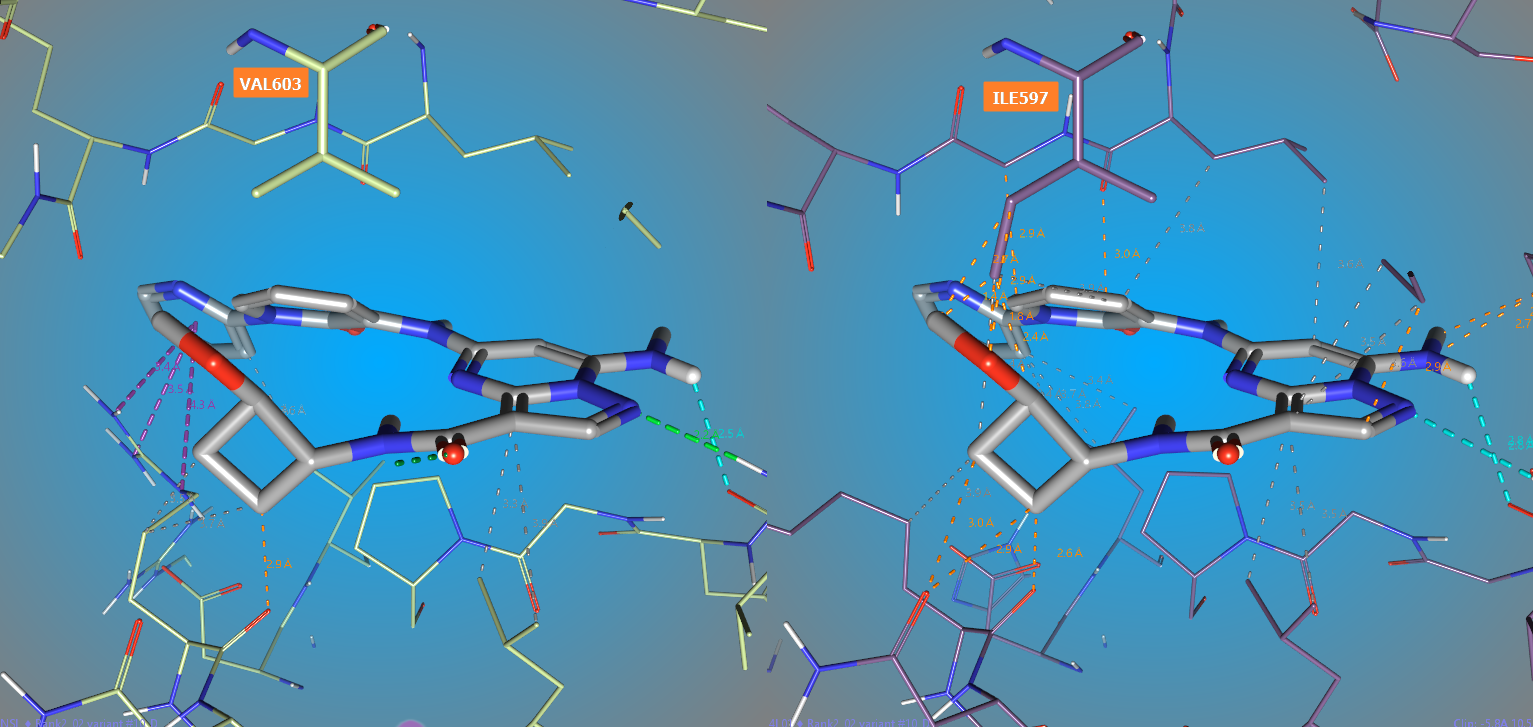
对Rank 2进行结构修饰的目的是提高靶标选择性并保持好的DMPK性质,正如之前讨论的那样,我们不必对所有的位置进行结构修饰,而是仅对朝向Val603的环丁烷C-H原子进行结构修饰,也就是酰胺邻位的那个,如图13所示。我们还认为,应该是酰胺的反式位置进行结构修饰。
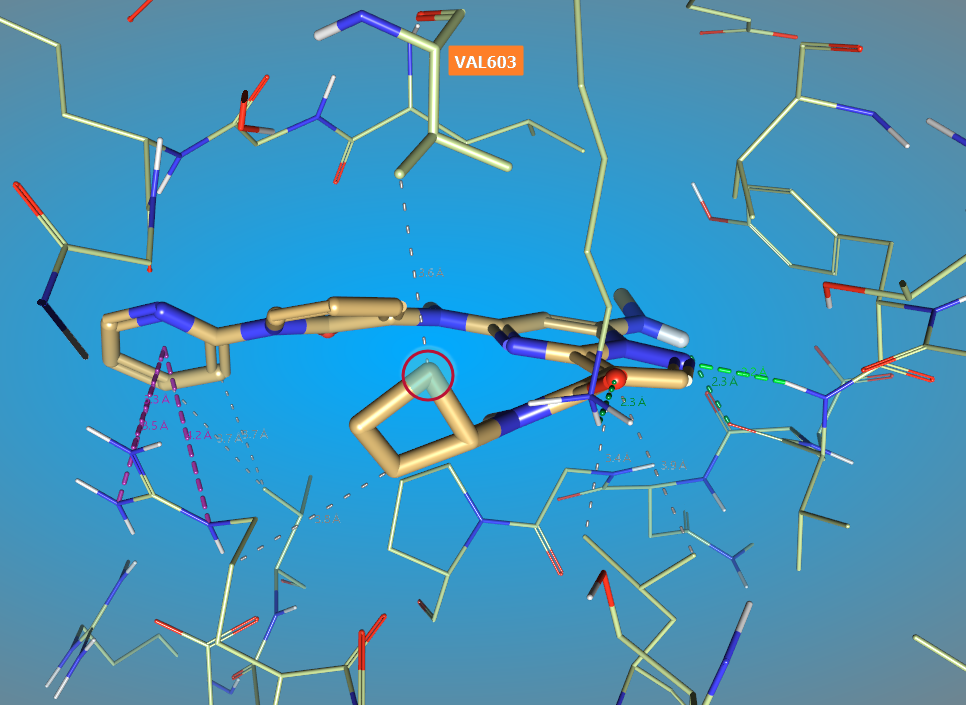
图13. Rank 2的环丁烷被红色圆圈标注的亚甲基离TYK2的Val603最近
Flare的Hit Expander是设计用来对先导化合物进行快速化学修饰的工具,因此环丁烷2位上的取修饰可以用Hit Expander来完成。在Flare选中如图2所示的环丁烷亚甲基,并在Hit Expander选择如图14的修饰策略,然后点击OK按钮即可一键生成衍生物。
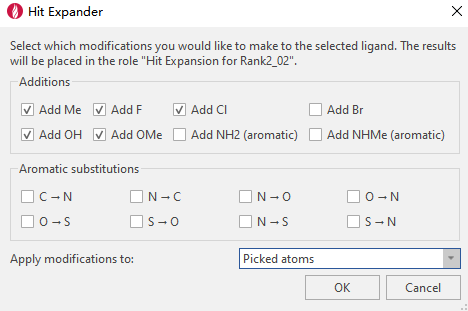
图14. Hit Expander的结构修饰策略
在本次计算中,我们得到10个衍生物,分别是-CH3、-F、-Cl、-OH与OCH3在环丁烷基2位上的取代。其中-OCH3取代直接导致了NDI-034858(即Rank2_02 variant #10)被设计出来,问题是:如何将这个化合物从其它化合物中突显出来。用6o周围结合位点的水分子信息可以得到充足的结构修饰提示,这一点在另一篇博文里进行讨论。
化合物的排序与优选
对化合物的排序与优选可以从几个角度进行:1)对靶标的活性;2)对靶标的选择性;3)DMPK性质。
鉴于DMPK性质的改善是BMS项目中的一个重要问题,对于没有经验的药化人员来说,并不容易判断微小的结构改变如何影响化合物的DMPK性质,因此如何定量、直观、精确地对于化合物优选非常重要,我先把这一部分内容留给凡默谷的专家与劲方的任洪灿博士(之前任职于上海和记黄埔医药)来撰写。我们已经有多次非常好的药化与DMPK协作案例,比如《用ADMET Predictor与SPARK重现和记黄埔的PI3Kγ/δ双重抑制剂优化的过程》。
首先,如前所述,甲氧基取代具有较好的DMPK性质预期;其次,甲氧基取代还具备好的靶标选择性预期,这些都使得甲氧基取代是最佳选择。分子对接计算表明,甲氧基取代的NDI-034358在TYK2 JH2的结合位点里,不仅保留着6o的结合模式,而且新引入的甲氧基并没有与Val603发生立体冲突,而在JAK1 JH2口袋里,由于-OCH3的引入导致与ILE597不可避免的立体冲突,如图15所示。
图15. NDI-034858在TYK2 JH2(左)与JAK1(右) JH2的结合模式比较
小结
在本文中,我们以BMS公开的6o化合物为起点,经SPARK进行骨架跃迁、Hit Expander的快速结构修饰,再进一步通过简单结构生物学信息与DMPK性质判断,将NDI-034858设计出来。
此外,敬请大家期待DMPK专家用专业工具与理论知识讲解对多个衍生物进行排序、优选到DMPK满意的化合物。
文献
- Takeda to Acquire Late-Stage, Potential Best-in-Class, Oral Allosteric TYK2 Inhibitor NDI-034858 From Nimbus Therapeutics. December 13, 2022. https://www.takeda.com/newsroom/newsreleases/2022/takeda-to-acquire-late-stage-potential-best-in-class-oral-allosteric-tyk2-inhibitor–ndi-034858-from-nimbus-therapeutics
- Liu, C.; Lin, J.; Moslin, R.; Tokarski, J. S.; Muckelbauer, J.; Chang, C.; Tredup, J.; Xie, D.; Park, H.; Li, P.; et al. Identification of Imidazo[1,2- b ]Pyridazine Derivatives as Potent, Selective, and Orally Active Tyk2 JH2 Inhibitors. ACS Med. Chem. Lett. 2019, 10 (3), 383–388. https://doi.org/10.1021/acsmedchemlett.9b00035.
- Nimbus Therapeutics Presents Additional Clinical Data from Phase 1 Studies of Oral Allosteric TYK2 Inhibitor at SID Annual Meeting. May 19, 2022. https://www.nimbustx.com/2022/05
- Baumgartner, M. P.; Evans, D. A. Side Chain Virtual Screening of Matched Molecular Pairs: A PDB-Wide and ChEMBL-Wide Analysis. J. Comput. Aided. Mol. Des. 2020, 34 (9), 953–963. https://doi.org/10.1007/s10822-020-00313-1.
- 侧链虚拟筛选:全PDB和ChEMBL数据分析. 墨灵格的博客. http://blog.molcalx.com.cn/2020/08/02/lilly-side-chain-vs.html
- Hit Expander——一种快速评估并逐步完成苗头到先导流程的新方法,湿化学费用最少. 墨灵格的博客. http://blog.molcalx.com.cn/2022/10/27/hit-expander.html