QM扭转角分析——控制依鲁替尼芳香轴构象提高靶标选择性
摘要:在本文中,我们用Flare QM对Ibrutinib及其构象控制的衍生物进行了QM扭转角分析,绘制扭转角-激酶活性图。结果表明,在没有其它因素的情况下,扭转角张力能惩罚高低与或化合物活性高低是一致,这可用来指导靶标选择性分子的设计。
肖高铿/2024-03-18
前言
伊鲁替尼(Ibrutinib,图1化合物1)是一种共价BTK抑制剂,已批准用于肿瘤的几个适应症。伊鲁替尼对许多激酶表现出明显的脱靶活性,常常导致患者出现不良反应。虽然在药物化学方面做出了巨大的努力,使第二代BTK抑制剂具有更高的选择性,但仍然需要有新的策略来快速提高激酶抑制剂的选择性。
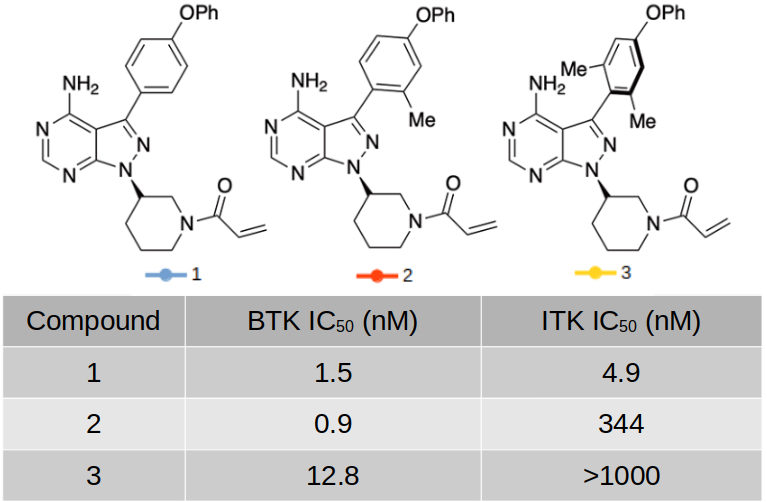
图1. 化合物1、2、3的化学结构式及其对BTK/ITK的IC50
最近,Toenjies等人1对依鲁替尼的芳香轴以5°的步长在B3LYP/6-31G(d)理论水平进行两面角扫描,发现低能构象(构象能不大于1.36 kcal/mol)与PDB数据得到的依鲁替尼及其类似物的生物活性构象具有30°的偏离,伊鲁替尼与BTK结合的二面角构象并不落在伊鲁替尼预测的低能量构象范围里,生物活性构象比理论零点能构象的能量高了~1kcal/mol。这意味着,为了保持其与BTK的结合构象,伊鲁替尼需付出1千卡/摩尔或更大的能量惩罚,在所有条件相同的情况下,这会导致一个数量级的结合亲和力损失。此外,伊鲁替尼的构象柔性能部分地解释它的脱靶活性,因为它能以多种构象与不同的脱靶激酶结合。通过合成一系列基态构象偏向低能构象的类似物,发现了一种带有两个邻甲基的类似物2、3(图1),显著增加了对BTK选择性。这项工作表明,围绕手性轴或前手性轴的进行构象控制是一种实现靶标选择性的策略。
本文的目的是用Flare软件包2的Flare QM3来重现Toenjies等人1报道的激酶选择性研究方法,以呈现Flare QM扭转角分析在构象设计方面的应用。具体地讲,以Ibrutinib的两个激酶靶标BTK与ITK为例,用Flare QM对依鲁替尼的芳香轴进行扭转角分析,绘制扭转角-激酶图并用来指导构象设计,提高依鲁替尼对BTK/ITK激酶的靶标选择性。
结果
Ibrutinib的BTK/ITK生物活性构象
分析Ibrutinib与BTK的共晶结构PDB 5P9I与5P9J,可以获得芳香轴两面角的分布在50-60°左右。图2-右是依鲁替尼共晶结构PDB 5P9J提取得到的生物活性构象,高亮原子定义的两面角为52.5°。
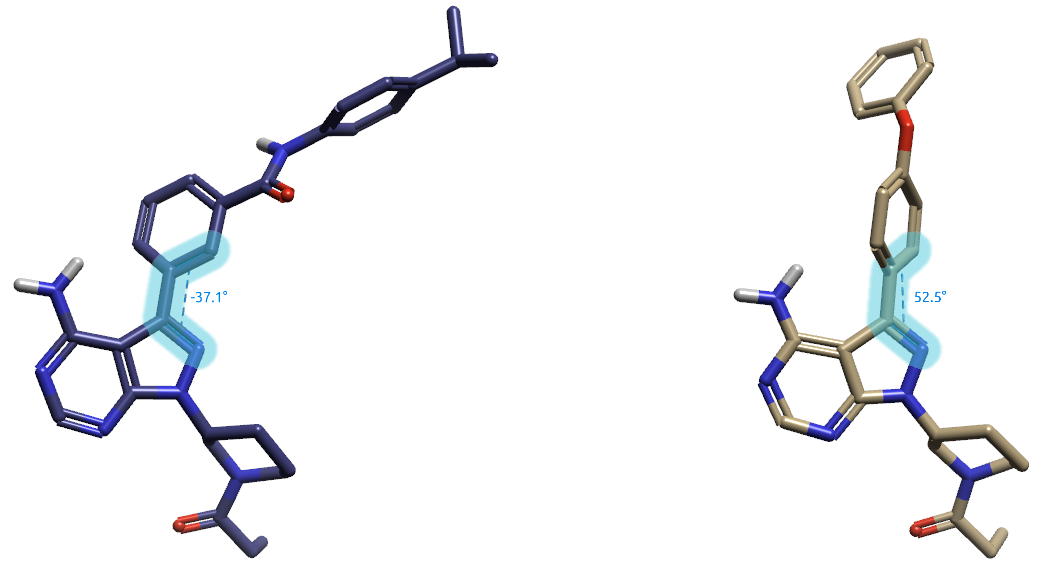
图2. Ibrutinib及其类似物的杂环芳香轴两面角。左:PDB 4HCU共晶配体13L;右:PDB 5P9J共晶配体8E8(Ibrutinib)。
尚未有Ibrutinib与ITK的共晶结构,但是Christoph等人4解释了几个Ibrutinib类似物与ITK的共晶结构PDB 4HCT、4HCU与4HCV,它们与Ibrutinib具有同样的共价弹头、Hinge区结合杂环片段。这些ITK共价抑制剂生物活性构象的杂环-苯环芳香轴两面角为-35~-40°。图2左显示了PDB 4HCU共晶配体的构象,高亮原子为关注的两面角=-37.1°。推测Ibrutinib与ITK结合时该两面角也应该在-35~-40°左右。
化合物1、2、3的扭转角分析
经典的扭转角分析是1D势能面扫描,而完整的分子含有多个柔性键,对含有多个柔性键分子的特定两面角进行1D扫描会导致构象遍历不充分、进而得到势能面不真实。因此我们不直接对化合物1、2、3进行扭转角分析,而是对这些化合物简化后的模型分子m1、m2与m3进行分析,结构与两面角如图3所示。
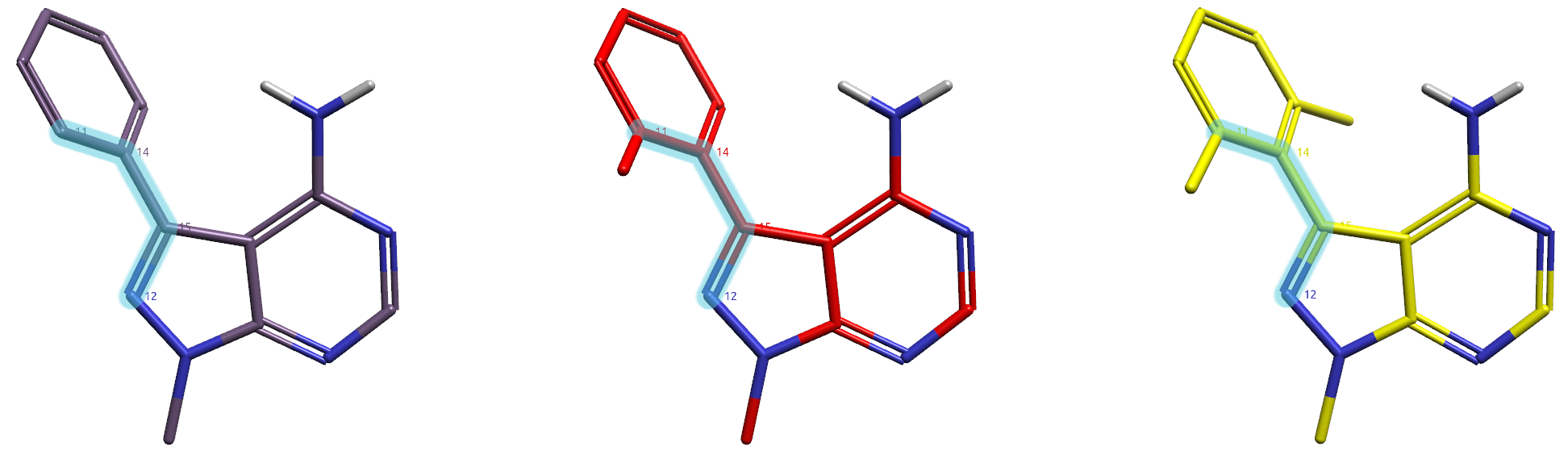
图3. Ibrutinib及其衍生物1、2、3的模型分子m1(左,棕色)、m2(中,红色)与m3(右,黄色)。高亮原子:QM扭转角分析的两面角。
采用Flare QM的Torsion profile在B3LYP-D3BJ6-311+G(d,p)理论水平下对模型化合物进行计算,然后将Ibrutinib的ITK与BTK活性构象两面角映射到扭转角分析图上,得到图4所示的扭转角-激酶图。
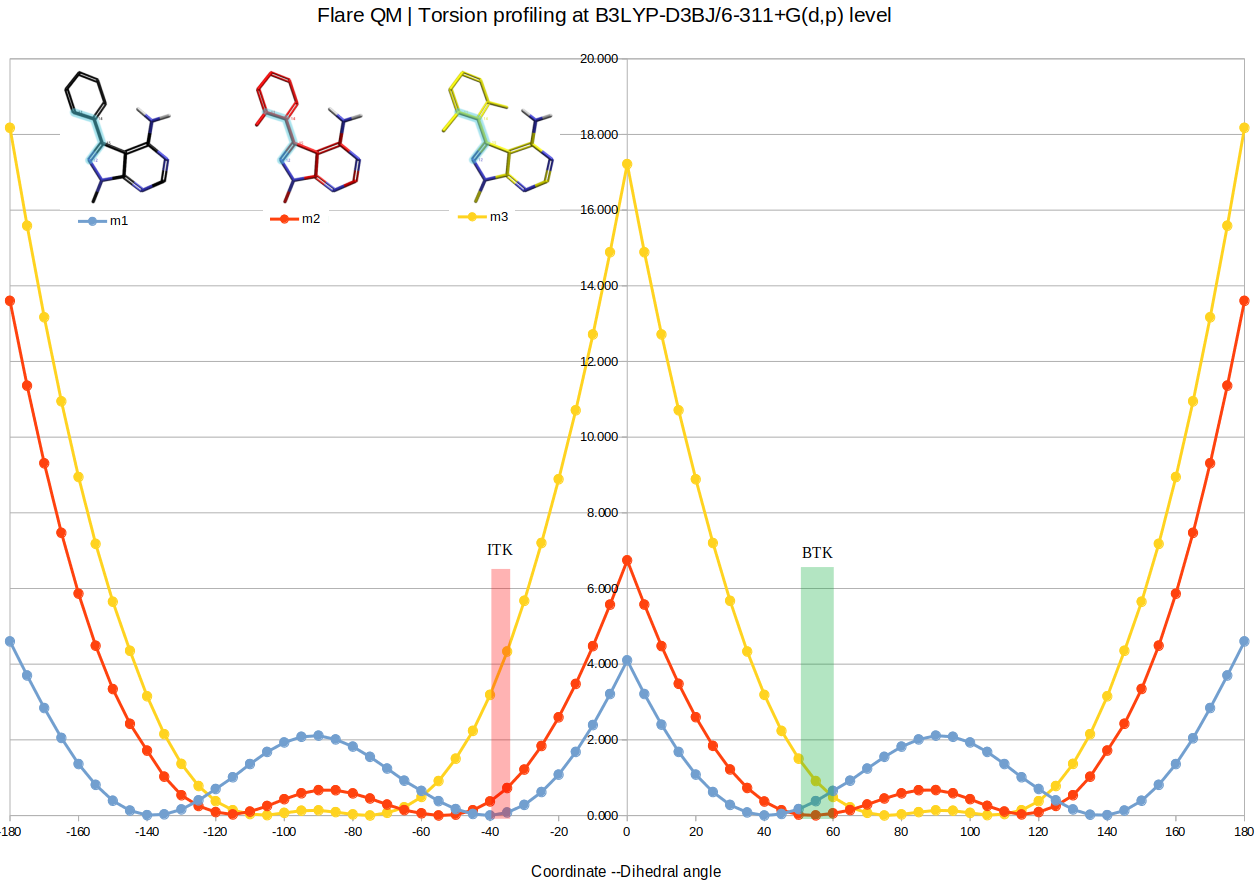
图4. 化合物1、2、3芳香轴扭转角-激酶靶标图。曲线:QM扭转角分析结果;绿色矩形:化合物与BTK结合时的两面角分布范围;红色矩形:化合物与ITK结合时的两面角分布范围。
从图4的扭转角-激酶靶标图可以看出,Ibrutinib与BTK、ITK结合时的生物活性构象均较低,对应的体外活性也都较高,IC50分别为1.5、4.9 nM。当苯环单甲基化时,与BTK结合的构象张力能进一步降低,而与ITK结合的构象张力能略有升高,这与它们对BTK的活性略有提高、对ITK的活性降低是一致的,IC50分别为0.9与344 nM。当苯环双甲基化时,与BTK结合的构象张力能轻微上升,而与ITK结合的构象张力能大幅升高,这与它们对BTK的活性略有降低、对ITK的活性降丧失是一致的,IC50分别为12.9与\(\gt\)1000 nM。总的来说,扭转角张力能惩罚高低与或化合物活性高低是一致,这可用来指导靶标选择性分子的设计。双甲基化衍生物实现了最好的BTK/ITK选择性。
方法
蛋白结构与配体结构的准备
将共晶结构下载到Flare V8,并用Protein Prep工具进行结构准备以添加氢原子、优化氢键、消除原子冲突并给蛋白结构与配体分配最佳质子化状态,并对截短的蛋白质链继进行封端。从准备好的复合物结构里将配体提取出来,得到配体的生物活性构象与蛋白结构。
QM几何优化
QM几何优化使用Flare QM的Minimize在BP86-D3BJ/DEF2-TZVP理论水平下计算。
模型分子的准备
模型分子是从上一步准备好的活性构象配体基础上截取得到,截小后的模型分子保留其构象与生物活性构象一致,并作为后续Torsion Profile分析的起点。
QM扭转角分析(Torsion Profile)
用Flare QM的Torsion Profile在B3LYP-D3BJ/6-311+G(d,p)理论水平下对模型分子的两面角进行扭转角分析,计算参数如下:
- Method: DFT
- DFT functional: B3LYP
- Use dispersion correction:Yes
- Basis set: 6-311+G(d,p)
- Convergence: Medium
- Max iterations: 500
- Number of rotomers: 72
- Degrees: 5.0°
- Max Threads: Auto
其中Degrees是根据Number of rotomers自动生成,无需主动设置,这里意味着以5.0°为步长进行两面角扫描。
结论
在本文中,我们用Flare QM对Ibrutinib及其构象控制的衍生物进行了QM扭转角分析,绘制扭转角-激酶活性图。结果表明,在没有其它因素的情况下,扭转角张力能惩罚高低与或化合物活性高低是一致,这可用来指导靶标选择性分子的设计。我们的计算与双甲基化衍生物具有最好的BTK/ITK选择性是一致的。
文献
- Toenjes, S. T.; Heydari, B. S.; Albright, S. T.; Hazin, R.; Ortiz, M. A.; Piedrafita, F. J.; Gustafson, J. L. Controlling Ibrutinib’s Conformations about Its Heterobiaryl Axis to Increase BTK Selectivity. ACS Med. Chem. Lett. 2023. https://doi.org/10.1021/acsmedchemlett.2c00523.
- Flare V8. https://www.cresset-group.com/software/flare-qm
- Flare QM. https://www.cresset-group.com/software/flare-qm
- Christoph W. Zapf; Brian S. Gerstenberger; Li Xing; David C. Limburg; David R. Anderson; Nicole Caspers; Seungil Han; Ann Aulabaugh; Ravi Kurumbail; Subarna Shakya; Xin Li; Vikki Spaulding; Robert M. Czerwinski; Nilufer Seth; and Quintus G. Medley. Covalent Inhibitors of Interleukin-2 Inducible T Cell Kinase (Itk) with Nanomolar Potency in a Whole-Blood Assay. J. Med. Chem. 2012, 55 (22), 10047-10063. DOI: 10.1021/jm301190s



