摘要:在缺乏蛋白-配体复合物结构的情况下,作者通过基于配体的方法FieldTemplater进行基于场的药效团分析以预测已知活性化合物的生物活性构象,并以预测的12aa活性构象为起点分子用Spark进行了生物等排体虚拟筛选,结果发现了一种新的SK1抑制剂SK-F,它在体外和体内表现出抗肿瘤活性,与DTX联合使用时没有明显毒性。
原文:Alshaker, H.; Srivats, S.; Monteil, D.; Wang, Q.; Low, C. M. R.; Pchejetski, D. Field Template-Based Design and Biological Evaluation of New Sphingosine Kinase 1 Inhibitors. Breast Cancer Res. Treat. 2018, 172 (1), 33–43. https://doi.org/10.1007/s10549-018-4900-1.
编译:肖高铿/2023-03-20
关于SK1抑制剂(SK1 inhibitor)
鞘氨醇激酶1(Sphingosine kinase 1,SK1)是一种在许多人类肿瘤中表达的原癌酶,与化疗耐药性和不良预后有关。它是一种有效的治疗靶点,其抑制作用可使实体瘤化学增敏。尽管最近在SK1抑制剂的合成和验证方面取得了进展,但它们的临床安全性和化学增敏选择并没有得到很好的描述。
虽然之前已有采用基于结构的设计方法来发现新的SK1抑制剂,但是很多时候我们没法利用现有的结构生物学信息,基于配体的方法还是很有必要的。Alshaker等人1报道了如何联合使用FieldTemplater预测生物活性构象与Spark进行生物等排体替换的基于配体设计方法,设计、合成并测试了一种毒性较低的新型特异性SK1抑制剂。本文的主要目的是分享该设计方法与过程。
方法与结果
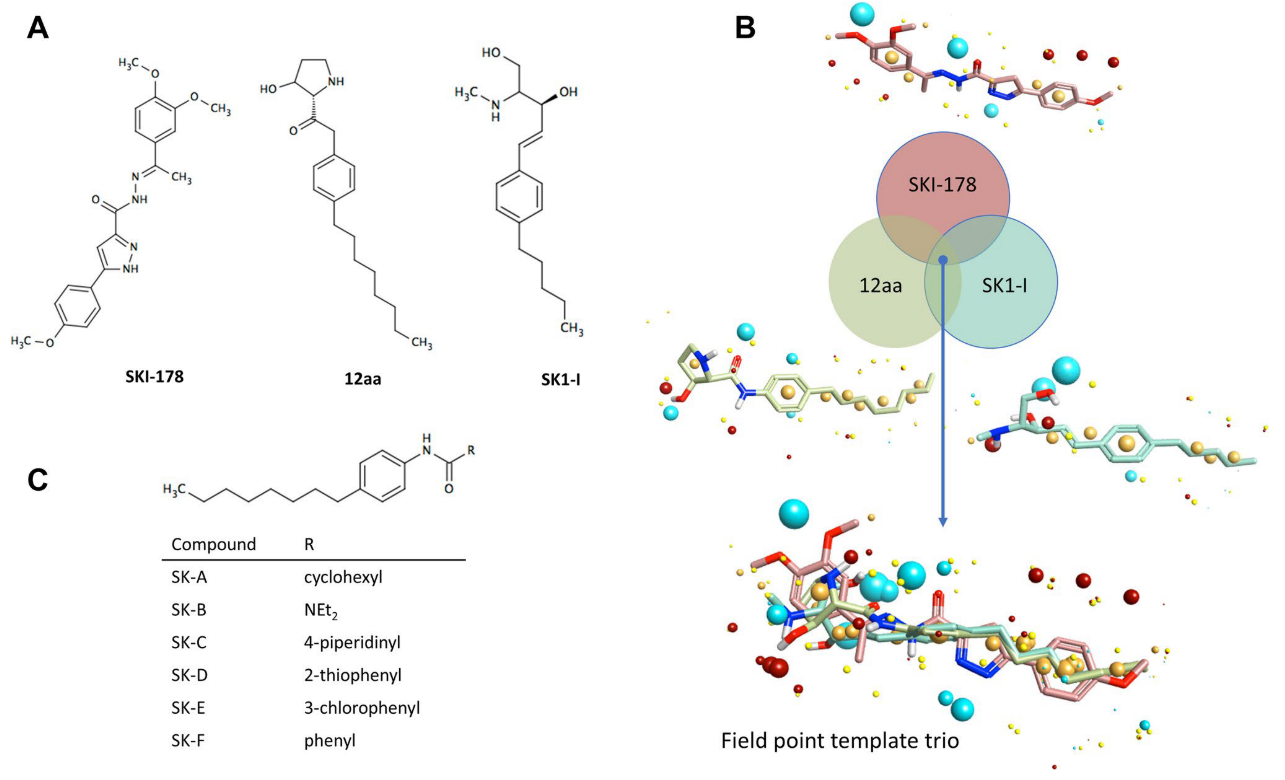
图1. 新化合物的设计流程
新化合物的设计流程如图1所示,在缺乏已知活性化合物与靶标蛋白共晶结构的情况下,作者从三个已知活性的化合物SFI-178、12aa与SK1-I出发(见图1 A),用FieldTemplater2搜寻它们的公共场点模式(场点药效团模型),得到它们可能的生物活性构象(图1 B),然后以预测的12AA的生物活性构象为起点分子,用Spark3对化合物12aa的头部进行生物等排体替换,旨在设计与起点分子具有高场点相似性的化合物。最后设计了从SK-A到SK-F六个可合成的新化合物(图1 C)并进行了合成与生物活性测试。
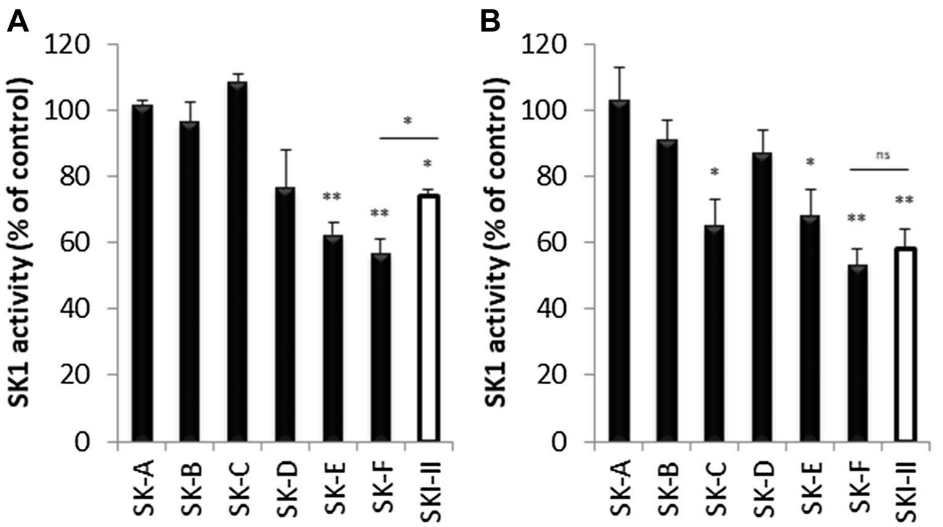
图2. SK-A到SK-F以及阳性对照SKI-II的SK1体外酶学活性与细胞活性测试
图2呈现了化合物以及阳性对照在无细胞提取物、体外对SK1的抑制作用。图2 A为酶学实验,将1µM的化合物SK-A至SK-F和SKI-II(阳性对照)在重组SK1(过量)、1µM ATP和1µM外源鞘氨醇存在下孵育1小时。图2 B为细胞水平实验,将MDA-MB-231细胞与1µM化合物SK-A到SK-F以及SKI-II孵育6小时。结果表明,化合物SK-D、E、F在酶学水平显示出抑制SK1的效果;而在MDA-MB-231人乳腺癌细胞系中SK-C、E、F显示出抑制活性。其中SK-F效果最为显著。
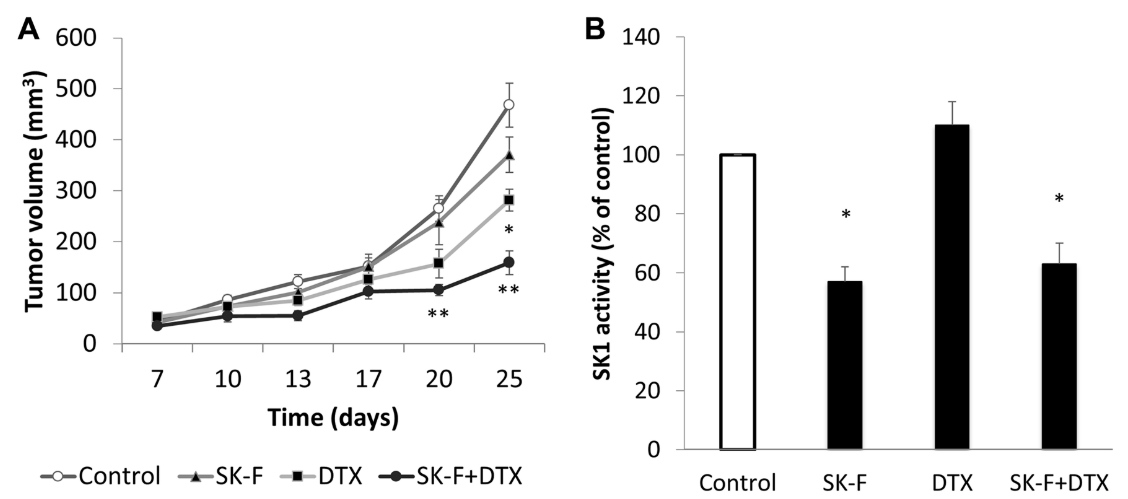
图3. 化合物SK-F体内活性测试实验:对乳腺肿瘤的生长与SK1活性测试结果
作者还研究了化合物SK-F对乳腺肿瘤生长和SK1活性的影响。通过将4T1细胞注射到BALB/c裸鼠乳腺垫中,建立乳腺癌异体移植瘤模型。植入后两周,将小鼠随机分为治疗组(n=6/组),每周两次,持续2周,腹腔注射DMSO、5 mg/kg DTX(docetaxel,DTX)、5 mg/kg SK-F、5 mg/kg DTX+5mg/kg SK-F。结果如图3所示,图3 A显示了不同治疗组的肿瘤体积。图3 B显示了使用放射性标记法测量肿瘤中的SK1活性。
作者选择了相对较小剂量的SK-F和DTX,以研究它们的联合作用和乳腺肿瘤对紫杉烷治疗的潜在化学增敏作用。如图3A所示,在对照组中肿瘤快速生长。与对照组相比,单独使用SK-F治疗的肿瘤体积显著减少,在研究结束时观察到最大的抑制肿瘤生长结果(体积分别为371和468 mm3)。5mg/kg DTX可诱导肿瘤体积显著减少至281mm3。当DTX与SK-F联合使用时,观察到肿瘤体积最大限度地减少到159mm3(图3 A)。与体外研究结果类似,化合物SK-F单独或与DTX联合治疗显著降低了肿瘤SK1的活性(图3 B)。
表1. 化合物SK-F对全身毒性的影响(对照组的%±SEM)
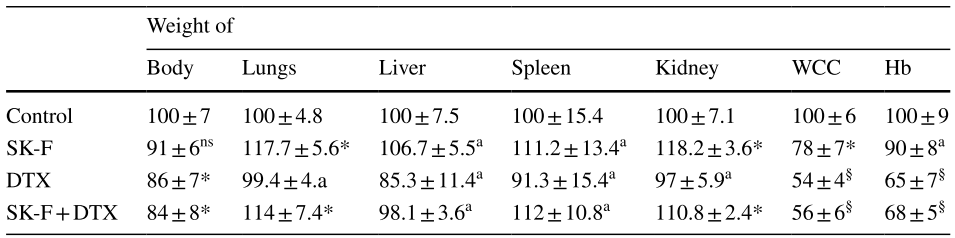
其中a: ns表示没有统计学显著性;*表示p小于0.05;**表示p小于0.01;§表示p小于0.001,均为与对照组相比。
作者进一步研究了SK-F治疗对小鼠全身毒性的影响。DTX降低了身体和肝脏的重量,而SK-F没有显著影响(表1)。DTX诱导了显著的贫血和白细胞减少,而SK-F的作用非常温和。在所有病例中,联合治疗的效果与单独使用DTX相似(表1)。肝功能测试被认为是化疗诱导的肝损伤的替代标志物,DTX诱导丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)显著升高,碱性磷酸酶(ALP)轻度升高。与DTX相比,SK-F具有较温和的毒性。联合治疗与单独使用DTX具有相似的毒性,同时具有更高的抗肿瘤疗效。
结论
用FieldTemplater对三种已知的SK1抑制剂SKI-178、12aa和SK1-I进行了基于场点的药效团分析,并以预测的12aa活性构象为起点分子用Spark进行了生物等排体虚拟筛选,确定了六种潜在的新SK1抑制剂。在无细胞和体外环境中进行的SK1活性测定表明,两种化合物是有效的SK1抑制剂。化合物SK-F在体外有效降低了癌症细胞的存活率,并在体内使小鼠乳腺肿瘤对多西紫杉醇(DTX)敏感,但没有显著的全身毒性。
总的来说,在缺乏蛋白-配体复合物的情况下,基于配体的方法FieldTemplater可以用来预测活性化合物的生物活性构象并提供给Spark进行生物等排体替换设计。本研究证明了这种基于配体设计方法的可靠性。
文献
- Alshaker, H.; Srivats, S.; Monteil, D.; Wang, Q.; Low, C. M. R.; Pchejetski, D. Field Template-Based Design and Biological Evaluation of New Sphingosine Kinase 1 Inhibitors. Breast Cancer Res. Treat. 2018, 172 (1), 33–43. https://doi.org/10.1007/s10549-018-4900-1.
- FieldTemplater. http://www.molcalx.com.cn/cresset/flare/fieldtemplater
- Spark. http://www.molcalx.com.cn/cresset/spark



