摘要:氟原子的引入不仅改变了乙烯基片段的静电性质,更可能通过形成 C–F⋯C=O 或 C–F⋯H–C 等弱相互作用,增强配体与靶蛋白的结合。尽管目前尚无共晶结构直接验证这些假设,但现有计算与活性数据强烈支持:(Z)-氟代烯烃是一种有效的酰胺生物电子等排体,其成功应用不仅改善了化合物的细胞渗透性,也维持了关键的靶标识别能力。
氟代烯烃作为酰胺的高效生物电子等排体
通过高通量筛选(High-throughput screening,HTS)对75000个化合物的评估,Xiang等人1发现了酰胺类二酰基甘油激酶(Diacylglycerol kinase, DGK)抑制剂的苗头化合物 1(图1),其对DGKζ的半数抑制浓度(IC50)为 15 μM。
图1. HTS苗头化合物1的化学结构
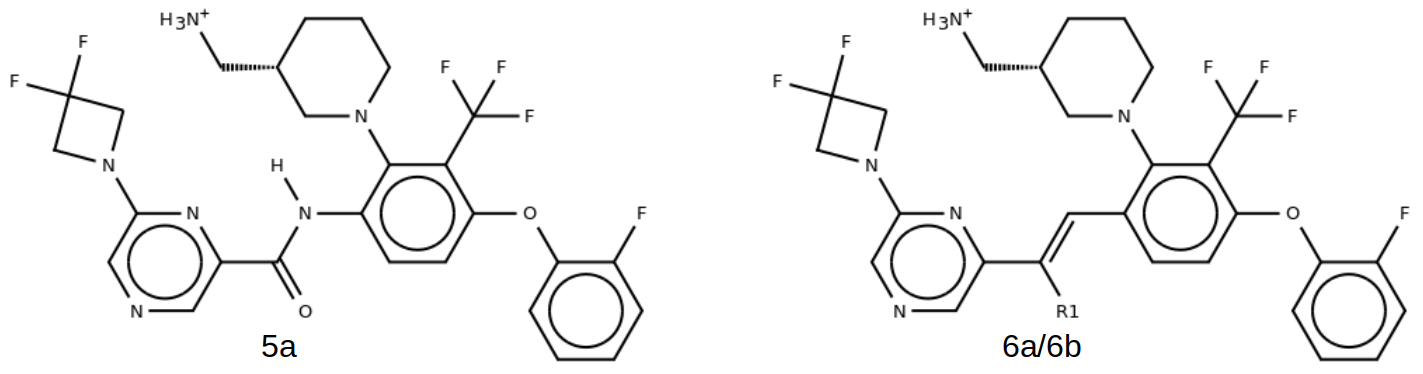
在随后的Hit-to-lead阶段,作者对苗头化合物1进行结构修饰,成功得到一系列强效、双重靶向 DGKα 与 DGKζ 的酰胺类抑制剂。其中代表性化合物 5a(图2)在酶学水平表现出优异活性:DGKα IC50 = 3.9 nM,DGKζ IC50 = 4.3 nM。
尽管 5a 在体外酶活性方面表现突出,其细胞水平活性却显著受限——在 Jurkat T 细胞中诱导白细胞介素-2(IL-2)分泌的半数有效浓度(EC50)高达 702 nM。作者推测,该类化合物中极性较强的酰胺键(同时具备氢键供体 HBD 与氢键受体 HBA 特性)可能是导致细胞膜渗透性差、进而削弱细胞活性的关键因素。因此,在先导化合物优化阶段,研究团队将核心目标设定为:寻找一种酰胺的生物电子等排体,既能维持与靶标蛋白的关键结合相互作用,又能改善类药性质(如降低极性、提升膜通透性)。
| Compound | R1 | DGKα IC50 (nM) |
DGKζ IC50 (nM) |
Jurkat IL-2 EC50 (nM) |
|---|---|---|---|---|
| 5a | – | 3.9 | 4.3 | 702 |
| 6a | F | 6.7 | 5.1 | 96 |
| 6b | H | \(>\)20000 | 9151 | – |
图2. 化合物5a、6a与6b的化学结构及其体外活性
在众多已报道的酰胺生物电子等排体中,(Z)-氟代烯烃(–CF=CH–)因其能高度模拟酰胺键的平面几何构型与偶极矩取向而备受关注2–6。受此启发,作者将 5a 中的酰胺键替换为 (Z)-氟代烯烃,得到化合物 6a。该结构改造在基本保留酶抑制活性的同时(DGKα IC50 = 6.7 nM,DGKζ IC50 = 5.1 nM),显著提升了细胞活性(Jurkat IL-2 EC50 = 96 nM),表明膜渗透性得到实质性改善。
为阐明 (Z)-氟代烯烃模拟酰胺键的分子机制,作者开展了量子化学计算分析,主要结论如下:
- 立体构象模拟性:氟代烯烃的键长、键角以及平面性与酰胺高度一致。
- 电子等排性:氟原子极高的电负性使其能够有效模拟羰基氧的偶极矩和静电势特征,并作为氢键受体参与靶标识别。
作者在DFT理论水平对5a与6a进行了基态几何优化后,其构象叠合结果表明:6a中的氟原子在空间位置上几乎与5a的羰基氧完全重合。这一结果表明,氟原子成功“占据”了原本由羰基氧在结合口袋中的关键位置,从而维持了与靶蛋白的类似氢键网络。为了进一步验证该假设,作者合成了去氟类似物 6b(-CH=CH-)。结果显示,6b 对 DGKα(IC50 \(>\) 20000 nM)与 DGKζ(IC50 = 9151 nM)的抑制活性完全丧失,从反面验证了氟原子在维持活性中的不可或缺性。
用QM比较分子的静电
值得注意的是,Olsen 等人7曾报道过一对凝血酶(thrombin)抑制剂的“活性悬崖”现象(图3):苯环对位引入氟原子后,抑制活性提升达 5.4 倍。该效应可归因于 C–F···C=O 或 C–F···H–C 等弱相互作用的形成,提示氟原子不仅作为电子等排体,还可能通过特定非共价作用增强结合亲和力。
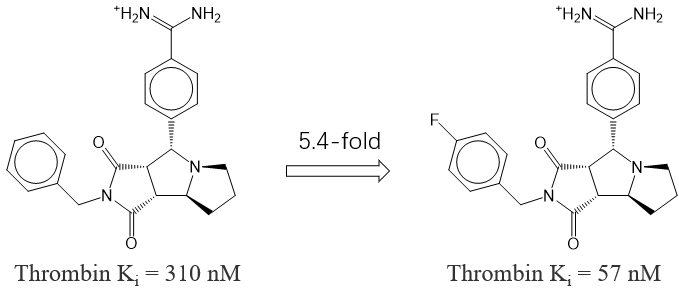
图3.苯环4-位氟取代使凝血酶抑制活性提升5.4倍,可能源于 C–F···C=O 等有利相互作用。
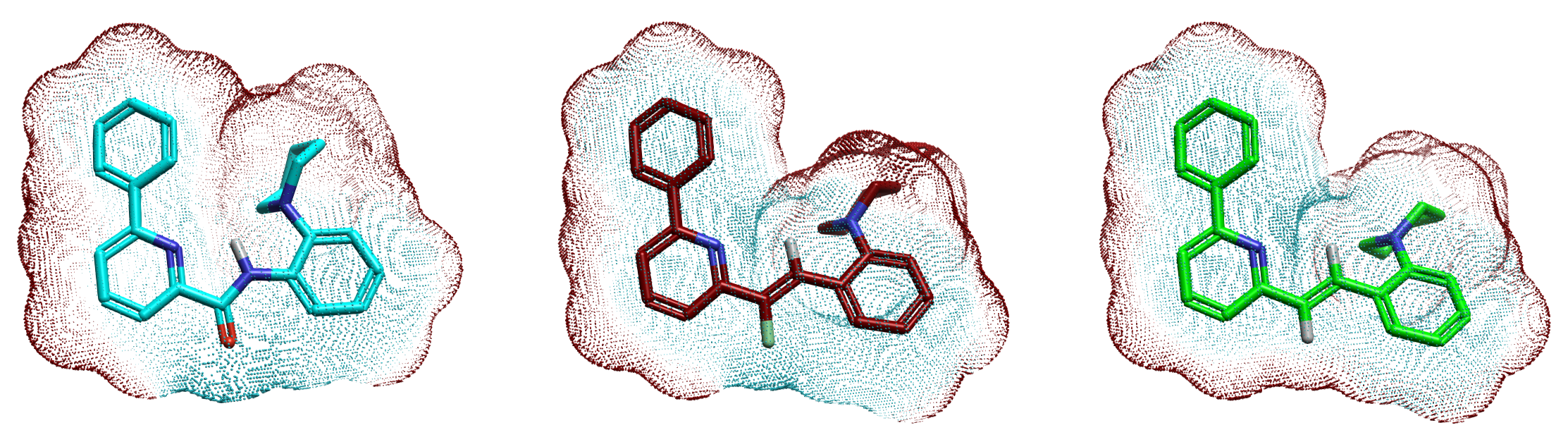
C–F···C=O 或 C–F···H–C 等弱相互作用的形成与C-F的静电特性相关。为了系统比较不同片段的静电特性,我们设计了模型化合物M1(酰胺)、M2(Z-乙烯基)和M3(乙烯基)等三个苗头化合物1的类似物,见图4。采用 Flare QM 在 B3LYP-D3BJ/6-31G(d) 理论水平对模型分子进行几何优化与分子表面静电势(molecular electrostatic potential, MESP)计算。结果表明:M1 与 M2 在羰基氧/氟原子区域均呈现显著的负静电势(蓝色),而 M3 的乙烯基区域则表现为正静电势(红色)。该结果从静电角度证实,氟代乙烯基可有效模拟酰胺羰基的电子特征,而未取代乙烯基则不能。
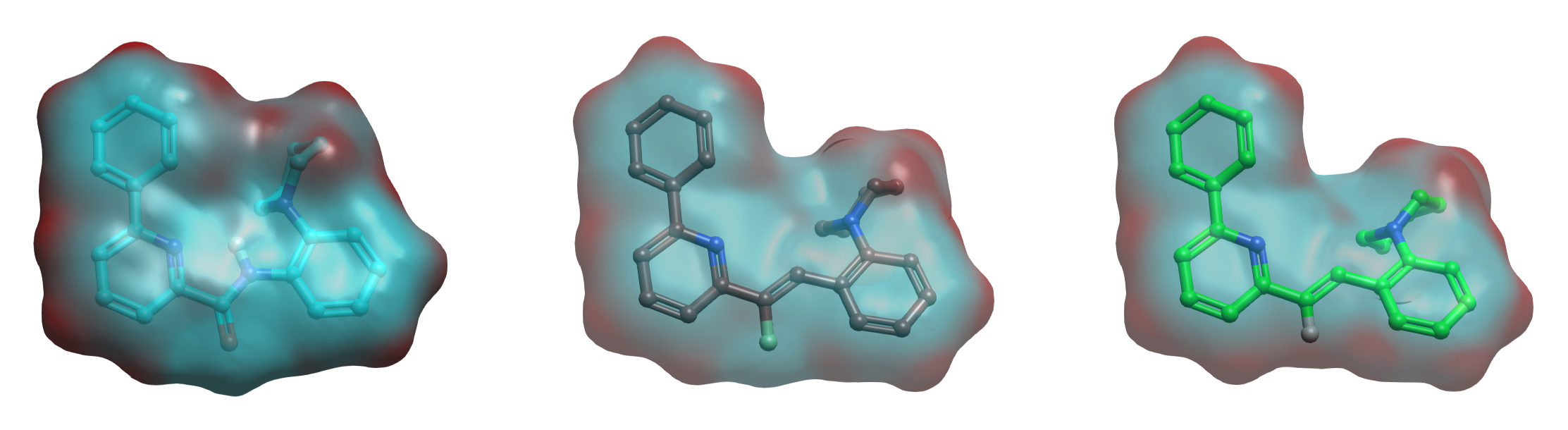
图4. 模型化合物M1(青色)、M2(棕色)、M3(绿色)的 QM 计算分子静电势表面。蓝色:负静电势;红色:正静电势。
为进一步量化静电差异,将计算所得的静电势投影至电子密度为 0.0004 的等值面上,生成基于量子力学的“场点”(QM field points)8(图5)。结果再次显示:M1 与 M2 在关键区域均分布有密集的负场点,而 M3 则呈现相反的正场点分布。

图5. 基于 QM 的场点:M1(青色)、M2(棕色)、M3(绿色)。红色:正场点;蓝色:负场点。
图6进一步聚焦于酰胺羰基氧周围的空间区域,直观揭示:M1 与 M2 在该区域内均以负静电场点为主,而 M3 则以正场点占主导。这一局部对比强化了前述结论。
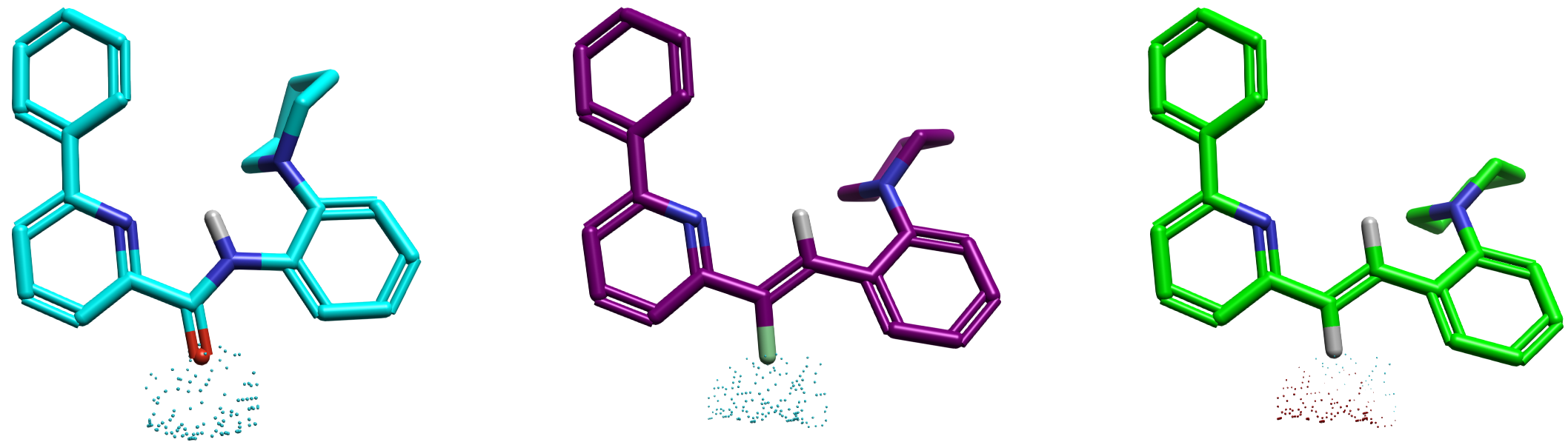
图6. 酰胺羰基氧邻近区域的 QM 场点分布。负场点(蓝色)在 M1 与 M2 之间高度相似,而 M3 显著不同。
用Boltz-2预测DGKα与6a的结合模式,主要参数如下:
- diffusion_samples:5
- sampling_steps: 500
预测的model_0的结合模式如图7所示,可以清楚看到 (Z)-乙烯基的F原子指向Lue196的羰基碳。这说明,6a的F原子确实有可能发生C–F···C=O 有利的相互作用。
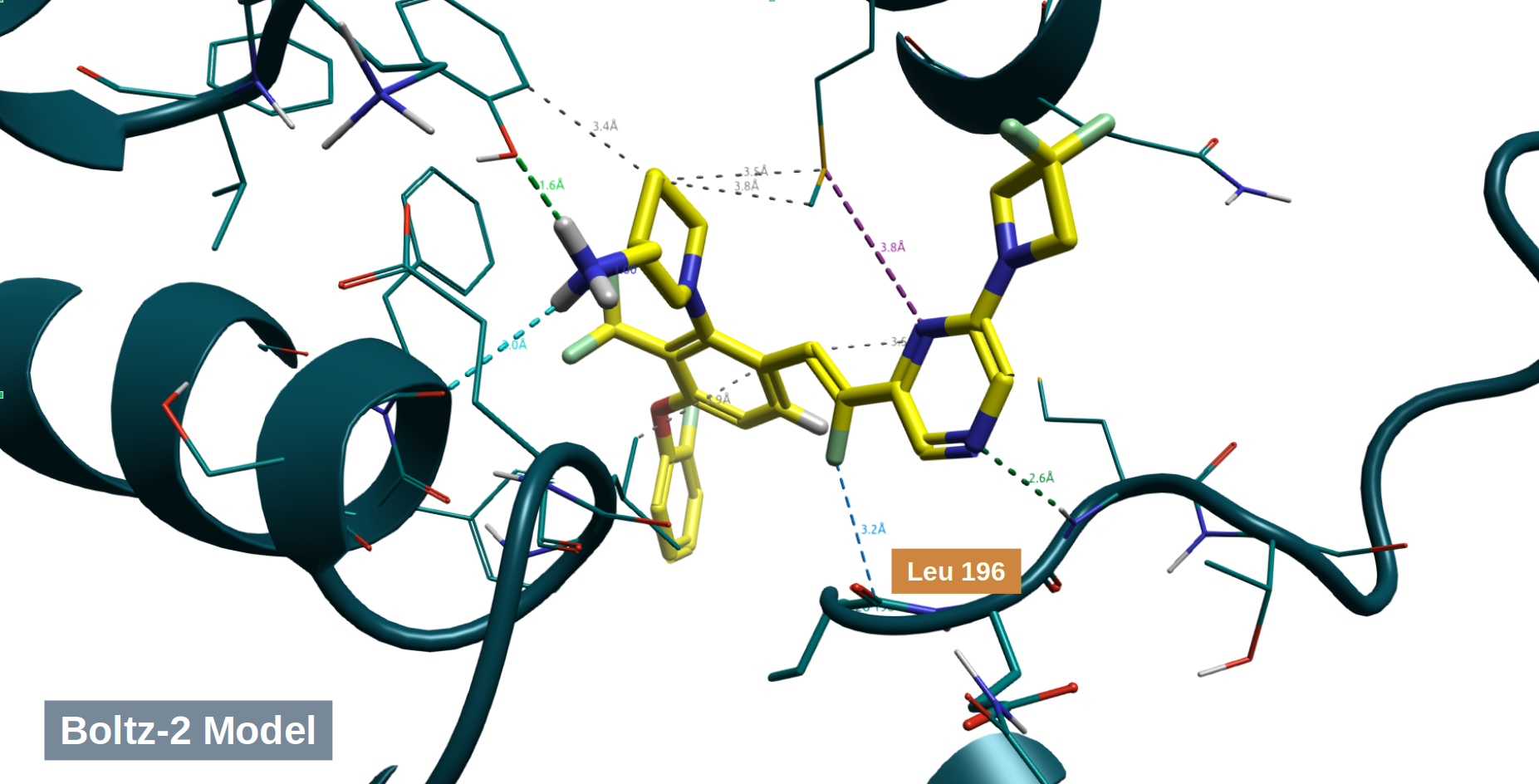
图7. Boltz-2预测的6a与DGKα的结合模式
在Olsen等人研究的凝血酶抑制剂体系中,单个氟原子的引入导致了约5.4倍的生物活性(IC50)差异;而在Xiang等人报道的二酰甘油激酶(DGK)抑制剂案例中,相同的取代却引发了超过2000倍的IC50变化。如此显著的活性差异仅通过形成C–F···C=O或C–F···H–C等弱非共价相互作用来解释,其机制令人难以置信,凸显了氟原子在药物分子设计中潜在的深远影响。这一现象亟待深入探究,尤其需要结合结构生物学等多维度手段进行系统评估,以明确氟化效应的内在机理及其在靶标识别与结合中的真实贡献。
结论
综上所述,氟原子的引入不仅改变了乙烯基片段的静电性质,更可能通过形成 C–F···C=O 或 C–F···H–C 等弱相互作用,增强配体与靶蛋白的结合。尽管目前尚无共晶结构直接验证这些假设,但现有计算与活性数据强烈支持:(Z)-氟代烯烃是一种有效的酰胺生物电子等排体,其成功应用不仅改善了化合物的细胞渗透性,也维持了关键的靶标识别能力。未来通过结构生物学手段(如 X-衍射晶体学)解析 6a 与 DGK 的复合物结构,将为这一设计策略提供决定性证据。
文献
- Xiang, M. et al. (2025) “Discovery of Fluoroalkenes as Dual Inhibitors of Diacylglycerol Kinases Alpha and Zeta (DGKα/ζ),” Journal of Medicinal Chemistry [Preprint]. Available at: https://doi.org/10.1021/acs.jmedchem.5c02098.
- Sedikides, A.T. and Lennox, A.J.J. (2024) “Silver-Catalyzed (Z)-β-Fluoro-vinyl Iodonium Salts from Alkynes: Efficient and Selective Syntheses of Z-Monofluoroalkenes,” Journal of the American Chemical Society, 146(23), pp. 15672–15680. Available at: https://doi.org/10.1021/jacs.4c03826.
- Nadon, J.-F. et al. (2017) “Synthesis of Gly-ψ[(Z)CF═CH]-Phe, a Fluoroalkene Dipeptide Isostere, and Its Incorporation into a Leu-enkephalin Peptidomimetic,” ACS Chemical Neuroscience, 8(1), pp. 40–49. Available at: https://doi.org/10.1021/acschemneuro.6b00163.
- Altman, R.A. et al. (2018) “Tyr1-ψ[(Z)CF═CH]-Gly2 Fluorinated Peptidomimetic Improves Distribution and Metabolism Properties of Leu-Enkephalin,” ACS Chemical Neuroscience, 9(7), pp. 1735–1742. Available at: https://doi.org/10.1021/acschemneuro.8b00085.
- Drouin, M., Laxio Arenas, J. and Paquin, J. (2019) “Incorporating a Monofluoroalkene into the Backbones of Short Peptides: Evaluating the Impact on Local Hydrophobicity,” ChemBioChem, 20(14), pp. 1817–1826. Available at: https://doi.org/10.1002/cbic.201900082.
- Kumari, S. et al. (2020) “Amide Bond Bioisosteres: Strategies, Synthesis, and Successes,” Journal of Medicinal Chemistry, 63(21), pp. 12290–12358. Available at: https://doi.org/10.1021/acs.jmedchem.0c00530.
- Olsen, J.A. et al. (2003) “A Fluorine Scan of Thrombin Inhibitors to Map the Fluorophilicity/Fluorophobicity of an Enzyme Active Site: Evidence for C-F⋅⋅⋅C=O Interactions,” Angewandte Chemie International Edition, 42(22), pp. 2507–2511. Available at: https://doi.org/10.1002/anie.200351268.
- 肖高铿. 用Flare QM分析C-H···O=C氢键相互作用. 墨灵格的博客. http://blog.molcalx.com.cn/2025/04/14/non-classical-hydrogen-bond-interactions-investigated-using-qm.html



